Огляд
Медичні працівники на всіх етапах надання медичної допомоги в умовах розгорнутих бойових дій повинні бути готові розпізнати та лікувати гострий коронарний синдром (ГКС). За оптимальних умов лікування починається з медикаментозної терапії та може супроводжуватися невідкладною коронарною ангіографією та реваскуляризацією. Однак, в умовах розгорнутих бойових дій, у більшості випадків, невідкладне черезшкірне коронарне втручання (ЧКВ) є недоступним, і час проведення такого втручання часто залежить від евакуації на далеку відстань. Ці настанови містять вказівки щодо найкращих методів лікування пацієнтів з ГКС в умовах розгорнутих бойових дій та умовах з обмеженими ресурсами.
Вихідна інформація
Ішемічна хвороба серця (ІХС) є основною причиною смертності в США та в усьому світі.1,2 Насправді, стан серцево-судинної системи у військовослужбовців, які перебувають на службі, може бути гіршим у порівнянні з цивільним населенням.3 Крім того, серцево-судинні захворювання є другою найпоширенішою категорією хронічних захворювань серед дійсних військовослужбовців Армії США після артриту.4 У той час, як клінічно ІХС, зазвичай, проявляється у старшому віці, значний коронарний атеросклероз та інфаркт міокарда можуть траплятися і в молодих людей та підлітків.5 У перехресному дослідженні, проведеному Веббером та іншими, коронарний атеросклероз був виявлений у 8,5% розтинів, проведених військовослужбовцям США під час операції «Свобода Іраку»/операції «Новий світанок» (OIF/OND) та операції «Нескорена свобода» (OEF).6 У цьому популяційному дослідженні старший вік, нижчий рівень освіти, вищий індекс маси тіла при вступі до армії та попередні діагнози дисліпідемії, гіпертензії та ожиріння були пов’язані з більшою поширеністю атеросклерозу. Крім того, інфаркт міокарда (ІМ)/ГКС був найпоширенішим медичним/нехірургічним діагнозом, який вимагав аеромедичної евакуації бригадою інтенсивної терапії (Critical Care Air Transport Team - CCATT), становлячи 6,6% із 290 пацієнтів, евакуйованих CCATT під час OIF/OEF.7
Гострий коронарний синдром, як правило, є наслідком ІХС і представляє спектр захворювань у пацієнтів, які мають ішемію міокарда або підозру на ішемію міокарда.8 ГКС поділяється на три підгрупи: 1) інфаркт міокарда з підйомом ST (STEMI), 2) інфаркт міокарда без підйому ST (NSTEMI) і 3) нестабільна стенокардія.
При обстеженні пацієнтів з підозрою на ГКС важливо враховувати інші життєво небезпечні причини болю в грудях, такі як емболія легеневої артерії, пневмонія, розшарування аорти, пневмоторакс, розрив стравоходу та міокардит, оскільки їх лікують по-різному. Ретельний збір анамнезу та фізикальне обстеження можуть допомогти бойовому медику поставити попередній діагноз. За наявності, візуалізаційні методи, лабораторні дослідження та електрокардіографія (ЕКГ) можуть додатково допомогти в диференціюванні етіології болю в грудях.9,10
Діагностика та лікування ГКС можуть бути надзвичайно складними в місцях, де недоступні центри ЧКВ або лікування фібринолітиками. ЧКВ рекомендоване в межах 120 хвилин після першого медичного контакту. Це є найкращим і найбільш поширеним методом лікування ГКС у США.11 Однак, якщо потрібна евакуація, затримка в досягненні центру ЧКВ може перевищувати рекомендований час “від дверей до балона” (door-to-balloon time). Зважаючи на це, військовим лікарям, які перебувають за межами континентальної частини Сполучених Штатів (OCONUS), може довестися лікувати ГКС фібринолітиками, що не є поширеним на більшості території США. Окрім того, багато діагностичних інструментів, які допомагають оцінити біль у грудях, наприклад ЕКГ та рівень серцевого тропоніну, можуть бути недоступні в умовах розгорнутих бойових дій. Див. Додаток С щодо рекомендованого алгоритму дій при ГКС залежно від етапу медичної допомоги.
Обов’язок кожного медичного працівника - бути готовим до початкового надання допомоги при ГКС, включаючи вміння використовувати телемедичний зв’язок. Діагностика та лікування ГКС повинні проводитись під керівництвом експерта-консультанта. Крім того, вміння знімати та надсилати ЕКГ і надавати першу “серцеву” допомогу за допомогою кисню, нітрогліцерину та аспірину є ключовими аспектами початкової стабілізації та мають бути доступними для всіх медичних працівників на полі бою. Розширені можливості для медичної стабілізації з використанням антиагрегантів, системних антикоагулянтів та фібринолітиків повинні бути доступні в ланцюзі евакуації в межах перших 24 годин, і це необхідно враховувати під час планування військової операції. Фібринолітики найкраще вводити в межах 12 годин після появи симптомів; однак, потенційна користь може зберігатися до 24 годин після появи симптомів.12,13
Діагностика
ГКС – це клінічний синдром, який включає ІМ та нестабільну стенокардію. ІМ може проявлятися як STEMI або NSTEMI. STEMI, зазвичай, виникає в результаті розриву бляшки та подальшого тромбозу коронарної артерії, що призводить до інфаркту та подальших змін на ЕКГ. При NSTEMI на ЕКГ не буде таких змін, як при STEMI. Проте NSTEMI також може виникнути внаслідок розриву бляшки (NSTEMI першого типу) або недостатнього кровотоку для задоволення метаболічних потреб міокарда при таких станах, як сепсис, легенева емболія або спазм коронарних судин (NSTEMI другого типу). У будь-якому випадку, як STEMI, так і NSTEMI призводить до підвищення рівня тропоніну. Нестабільна стенокардія характеризується виникненням нового нападу болю в грудях, що триває більше 20 хвилин, або болем у спокої чи при мінімальному навантаженні. Хоча нестабільна стенокардія може давати зміни на ЕКГ (які не є діагностичними щодо STEMI), вона не супроводжується підвищеним рівнем тропонінів.10 Важливо розрізняти STEMI та NSTEMI, оскільки пацієнти зі STEMI потребують невідкладного коронарного втручання.9 NSTEMI зустрічається частіше, ніж STEMI, і становить 60-70% випадків інфарктів міокарда.14 NSTEMI з коронарною оклюзією присутній у 25% випадків.15
Біль при ГКС класично описується як біль у грудній клітці при фізичному навантаженні, тиснучого характеру, з іррадіацією в щелепу, шию, одну чи обидві руки/плечі або спину. Він може супроводжуватися нудотою/блюванням, задишкою та потовиділенням.10 Атипові симптоми (лише задишка, втомлюваність, слабкість, біль в епігастральній ділянці, серцебиття, втрата свідомості, нудота без інших ознак, зупинка серця) частіше спостерігаються у людей похилого віку, жінок і хворих на цукровий діабет. Атипові симптоми спостерігаються в однієї третини підтверджених випадків інфаркту міокарда.16
Тропонін — це білок, який вивільняється з тканини міокарда і є ознакою загибелі клітин серця. Рівень тропоніну в сироватці починає помітно зростати вже через 2-3 години після початку і може залишатися підвищеним протягом 7 днів.10 Якщо доступно, для діагностики ІМ слід використовувати визначення серцевого тропоніну (кардіоспецифічний тропонін I або T). Рівень тропоніну вище 99 перцентиля відносно верхньої межі норми (визначається типом аналізу) вважається позитивним. Рівень тропоніну може продовжувати зростати або може знижуватися залежно від часу, коли клінічна подія відбулася, і обидві ситуації повинні викликати підозру щодо ГКС.10,17 Через те, що від моменту загибелі серцевих клітин до лабораторного виявлення підвищеного рівня тропоніну має пройти певний час, рівень тропоніну слід перевіряти декілька разів, як правило, кожні 3-6 годин.18
Нижче наведені клінічні ознаки, що в поєднанні з підвищенням і/або зниженням рівня тропоніну підтверджують діагноз гострого ІМ:19
- Симптоми ішемії (Див. розділ вище)
- Нові ішемічні зміни на ЕКГ
- Поява патологічних зубців Q
- Докази нової втрати життєздатного міокарда або нової ділянки порушення рухливості стінок серця за допомогою візуалізації
- Виявлення внутрішньокоронарного тромбу при ангіографії або аутопсії
Підвищеним рівнем тропоніну можуть проявлятися й інші клінічні стани. Деякі з цих станів можуть мати симптоми, подібні до ГКС (міокардит, легенева емболія та розшарування аорти), тоді як інші стани можуть бути без ознак ГКС (наприклад, рабдоміоліз, сепсис та гостра ниркова недостатність), і їх лікування відрізняється від лікування ГКС.19 Тому в діагностиці ГКС, в сукупності з рівнем тропоніну важливо враховувати клінічні прояви та результати додаткових досліджень (ЕКГ, ехокардіографія). Майте на увазі, що в віддалених місцях бойових дій, лабораторне тестування на тропонін, скоріше за все, буде недоступним. Тому за наявності відповідних клінічних симптомів слід зберігати високий рівень підозри.
Діагностика ГКС з використанням ЕКГ-ознак
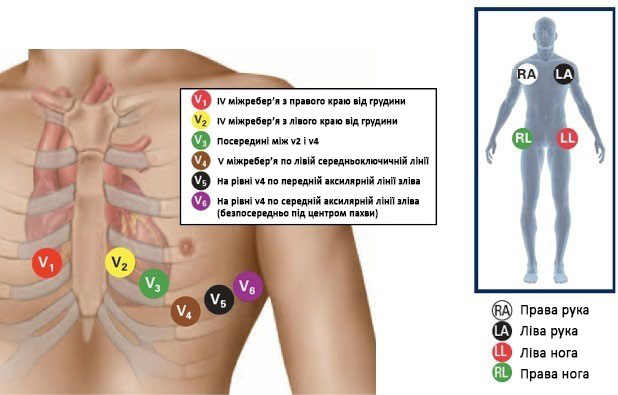
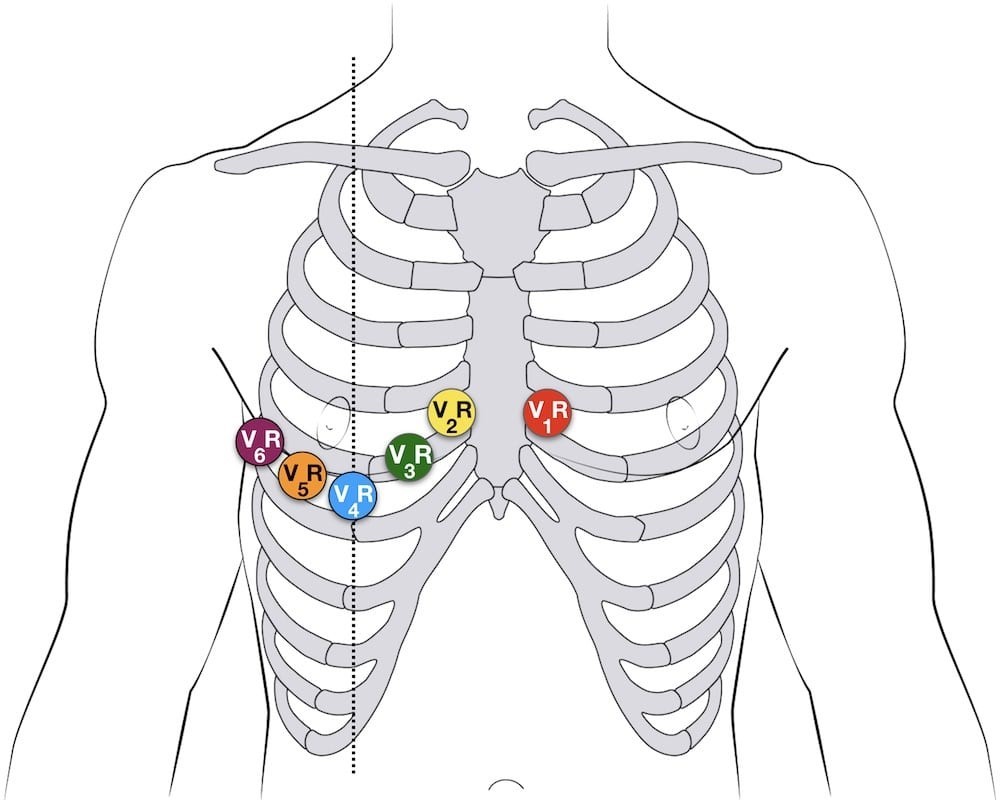
Стандартна ЕКГ інфаркту міокарда з елевацією ST (STEMI) відображає зміни ділянки міокарда, яка кровопостачається з тієї артерії, в якій стався інфаркт. Елевація сегмента ST в одній ділянці повинна проявлятися реципрокною депресією ST в протилежній анатомічній ділянці. Діагностичне значення має елевація ST у двох суміжних відведеннях. На малюнку 1 показано правильне розташування електродів ЕКГ для стандартної ЕКГ у 12 відведеннях.
Малюнок 1. Правильне розташування електродів при стандартній ЕКГ у 12 відведеннях20
У поєднанні з симптомами, що відповідають ішемії міокарда, критеріями діагностики STEMI є наступні зміни на ЕКГ:19
- Поява нової елевації сегмента ST ≥ 0,1 мВ у 2 або більше суміжних відведеннях, крім V2-V3
- Нова елевація сегмента ST у V2-V3 з наступними критеріями:
- ≥ 0,25 мВ у чоловіків віком < 40 років
- ≥ 0,2 мВ у чоловіків віком ≥ 40 років
- ≥ 0,15 мВ у жінок
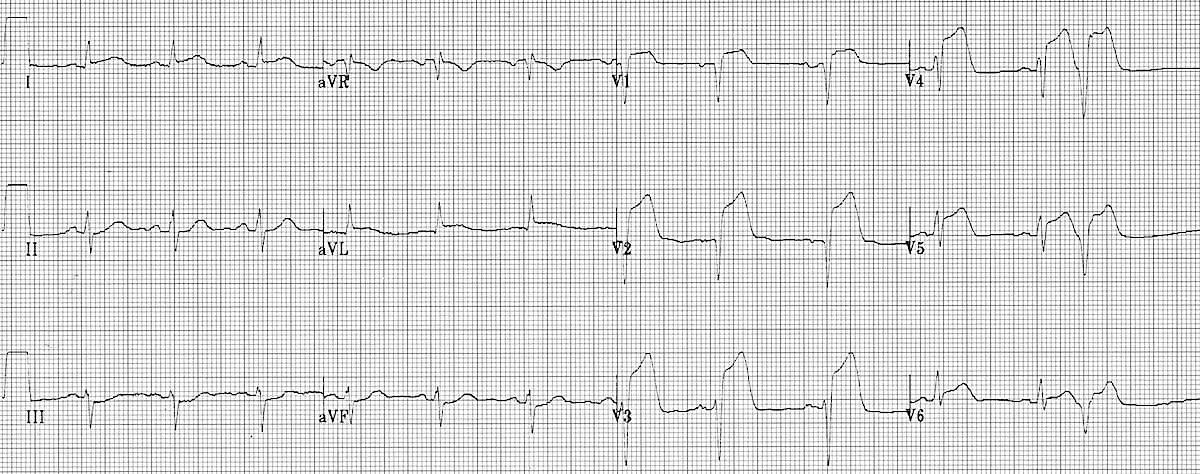
На малюнках 2-4 показано типові картини STEMI передньої, нижньої та бічної стінок лівого шлуночка (ЛШ) відповідно.
Малюнок 2. ЕКГ у 12 відведеннях: STEMI передньої стінки ЛШ. Зверніть увагу на елевацію ST у відведеннях I, aVL і V1-V6 з реципрокною депресією ST у нижніх відведеннях (III та aVF)21
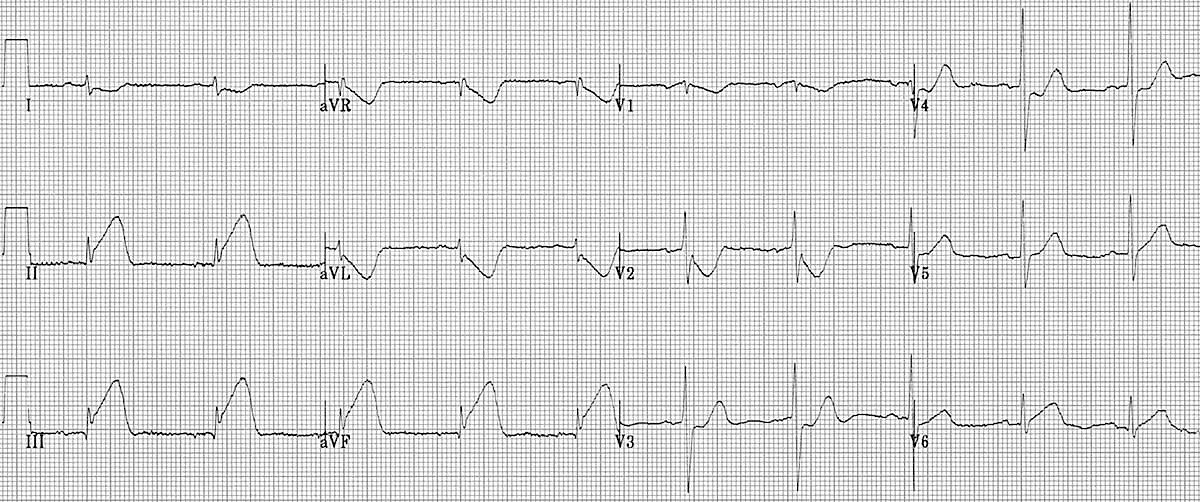
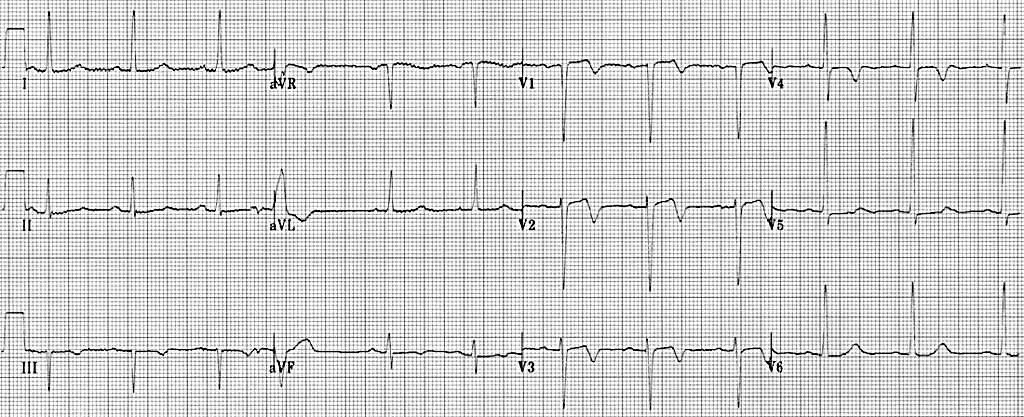
Малюнок 3. ЕКГ у 12 відведеннях: STEMI нижньої стінки ЛШ. Зверніть увагу на підйом ST у відведеннях II, III та aVF з реципрокною депресією ST у передньо-бокових відведеннях (I, aVL, V2, V3 and V4)22
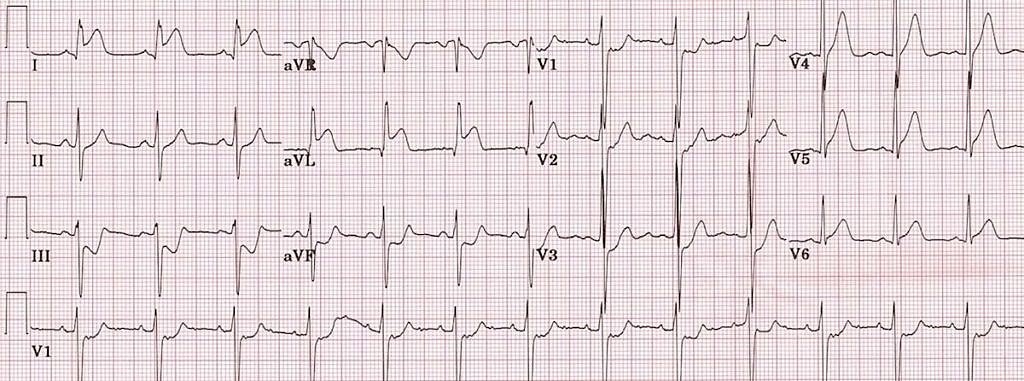
Малюнок 4. ЕКГ у 12 відведеннях: STEMI бічної стінки ЛШ. Зверніть увагу на елевацію ST у відведеннях I, aVL, V5 і V6 з реципрокною депресією ST у нижніх відведеннях (II, III та aVF) 23
Окрім стандартних, діагностичних для STEMI ознак на ЕКГ, на даний час існує лише один загальновизнаний «еквівалент STEMI», яким є блокада лівої ніжки пучка Гіса (БЛНПГ), що відповідає критеріям Сгарбосси.19
Інші патерни ЕКГ, які повинні викликати високу підозру на STEMI, включають патерн де Вінтера, патерн при ураженні стовбура лівої коронарної артерії, “надгострі” зубці Т, синдром Велленса та задній ІМ. Ці патерни не вважаються еквівалентом STEMI, але в таких випадках потрібно все одно розглядати варіант екстреної/невідкладної реваскуляризації, використовуючи ЧКВ.24 Інтерпретація ЕКГ може бути складною, тому слід подумати про термінову телемедичну консультацію з кардіологом. Зміни на ЕКГ, які також повинні викликати занепокоєння щодо ішемії, включають депресію ST ≥ 0,5 мм (у ≥ 2 суміжних відведеннях) або інверсію зубця Т.
- БЛНПГ з критеріями Сгарбосси – Критерії Сгарбосси були розроблені для виявлення гострого ІМ на фоні БЛНПГ, оскільки зміни ST і T при БЛНПГ ускладнюють ідентифікацію ІМ. Вважається, що на ЕКГ є ІМ, якщо виконується будь-який із наступних трьох критеріїв, а загальна сума набраних балів дорівнює ≥ 3:25
- Конкордантна до основного зубця комплексу QRS елевація сегмента ST ≥1 мм в одному або більше відведенні (5 балів)
- Конкордантна до основного зубця комплексу QRS депресія сегмента ST ≥1 мм в одному або більше відведеннях V1, V2, V3 (3 бали)
- Дискордантна до основного зубця комплексу QRS елевація сегмента ST ≥5 мм хоча б в одному відведенні (2 бали)
- Модифіковані критерії Сгарбосси (наведено нижче) вважаються зручнішими та точнішими за оригінальні.26 Для визначення ІМ за модифікованими критеріями діагностичною є будь-яка з перелічених нижче змін.
- Конкордантна до основного зубця комплексу QRS елевація сегмента ST ≥1 мм в одному або більше відведенні
- Конкордантна до основного зубця комплексу QRS депресія сегмента ST ≥1 мм в одному або більше відведеннях V1, V2, V3
- Одне або більше відведення, де присутня елевація ST на 1 мм або більше, за умови її вираженої дискордантності: 25% і більше від амплітуди попереднього зубця S (співвідношення ST:S ≤ 0,25)
Малюнок 5. ЕКГ у 12 відведеннях: STEMI відповідно до модифікованих критеріїв Сгарбосси
https://epmonthly.com/article/stemi-in-the-presence-of-lbbb/
Патерни ЕКГ, які викликають високу підозру на інфаркт міокарда
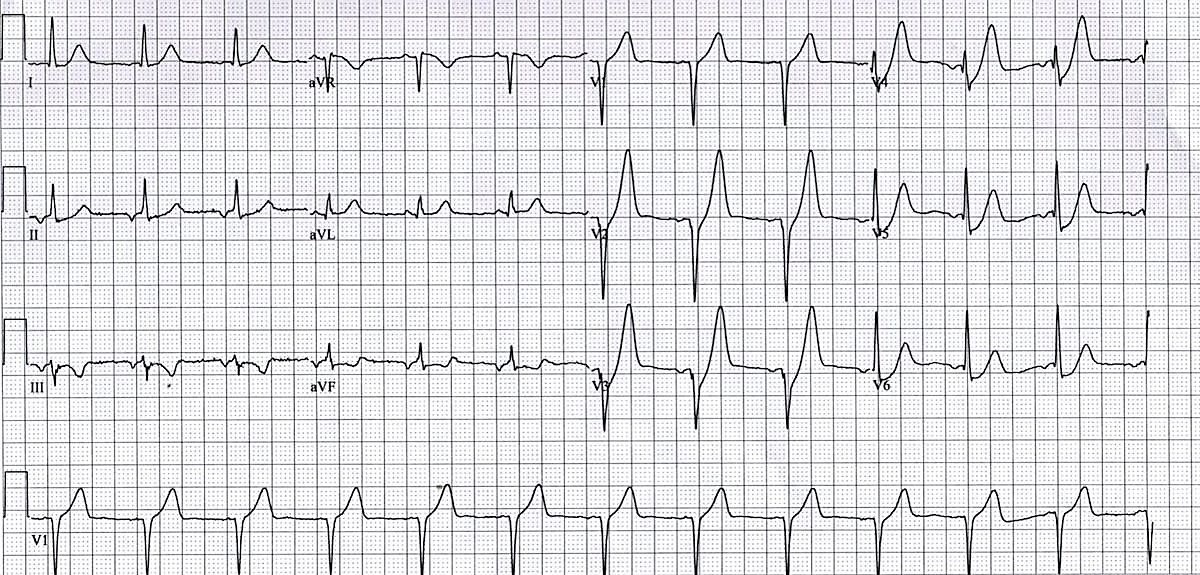
- Патерн де Вінтера: Депресія ST в точці J у V1-V6, а також високі загострені симетричні зубці Т - відповідають патерну де Вінтера та пов’язані з оклюзією проксимального сегмента лівої передньої низхідної артерії (LAD).
Малюнок 6. ЕКГ у 12 відведеннях: STEMI відповідно до патерну де Вінтера27
- Патерн при ураженні стовбура лівої коронарної артерії - Депресія ST у багатьох відведеннях із супутньою елевацією ST у відведенні aVR була описана у пацієнтів із оклюзією стовбура лівої коронарної артерії або проксимального відділу лівої передньої низхідної артерії.
Малюнок 7. ЕКГ у 12 відведеннях: STEMI при ураженні стовбура лівої коронарної артерії28
- “Надгострі” зубці Т – на ранніх стадіях STEMI можна побачити широкі асиметричні загострені зубці T.
Малюнок 8. ЕКГ у 12 відведеннях: STEMI з “надгострими” зубцями Т29
- Синдром Велленса – Двофазні зубці Т (тип А) або глибокі симетричні інвертовані зубці Т (тип В) у відведеннях V2-V3 тісно пов’язані з проксимальною оклюзією лівої передньої низхідної артерії (LAD). Це називається синдромом Велленса.
Малюнок 9. ЕКГ у 12 відведеннях: STEMI з двофазними зубцями Т, що вказує на синдром Велленса30

Малюнок 10. ЕКГ у 12 відведеннях: STEMI з глибокими симетричними інвертованими зубцями Т, що вказують на синдром Велленса30
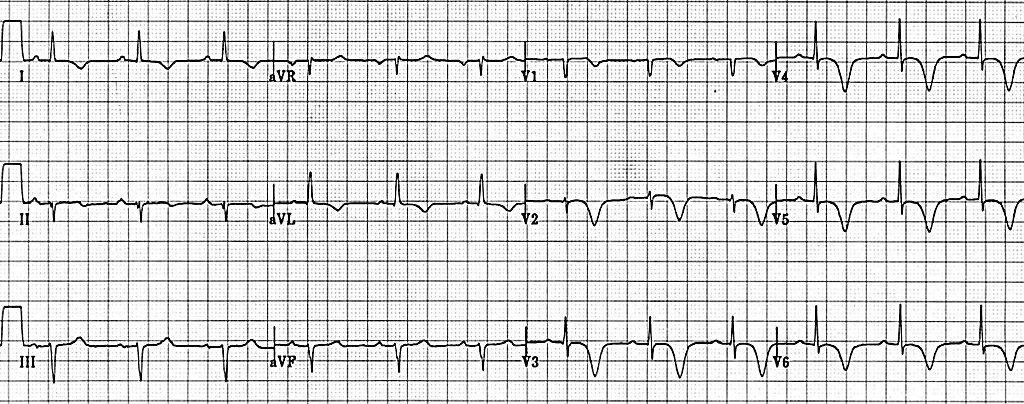
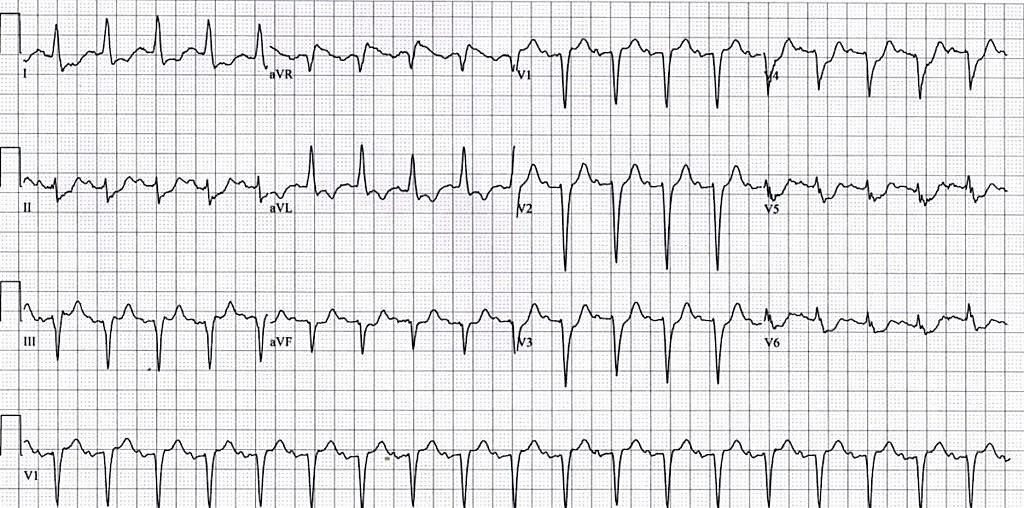
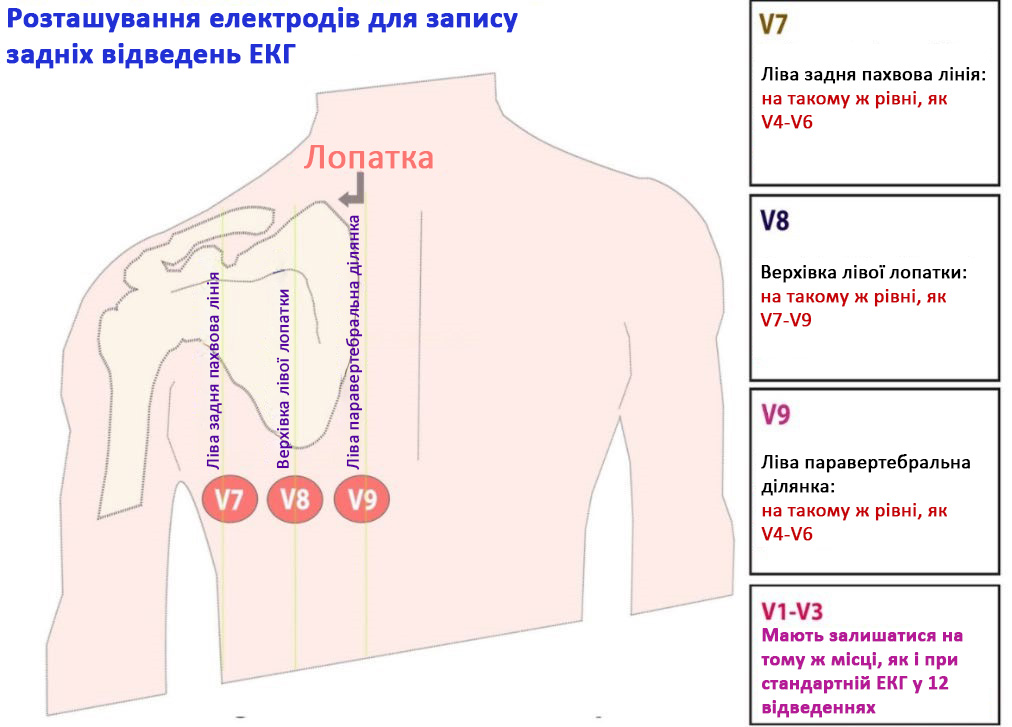
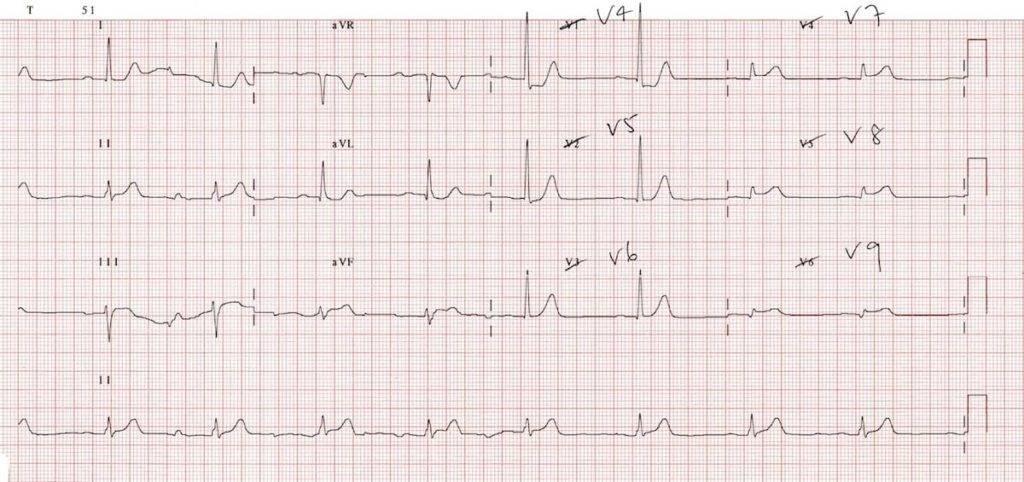
Ще однією ознакою гострої ішемії серця на ЕКГ є плоска або низхідна депресія ST ≥ 0,5 мм у 2 суміжних відведеннях (Малюнок 11). Якщо у відведеннях V1-V3 спостерігається депресія ST, тоді наступним кроком має бути отримання ЕКГ у задніх відведеннях. Для цього слід зняти електроди V4-V6 з пацієнта та розмістити їх по нижньому краю лівої лопатки, як показано на Малюнку 12. Якщо у цих відведеннях (які тепер мають назву V7-V9) на ЕКГ є підйом сегмента ST, то можна говорити про STEMI задньої стінки ЛШ (Малюнок 13).
Малюнок 11. ЕКГ у 12 відведеннях: депресія ST у V2-V3 - підозра на STEMI задньої стінки ЛШ 31
Малюнок 12. Розташування електродів для запису задніх відведень ЕКГ32
Малюнок 13. ЕКГ у 12 відведеннях: STEMI задньої стінки ЛШ. Зверніть увагу на елевацію сегмента ST у задніх відведеннях V7-V931
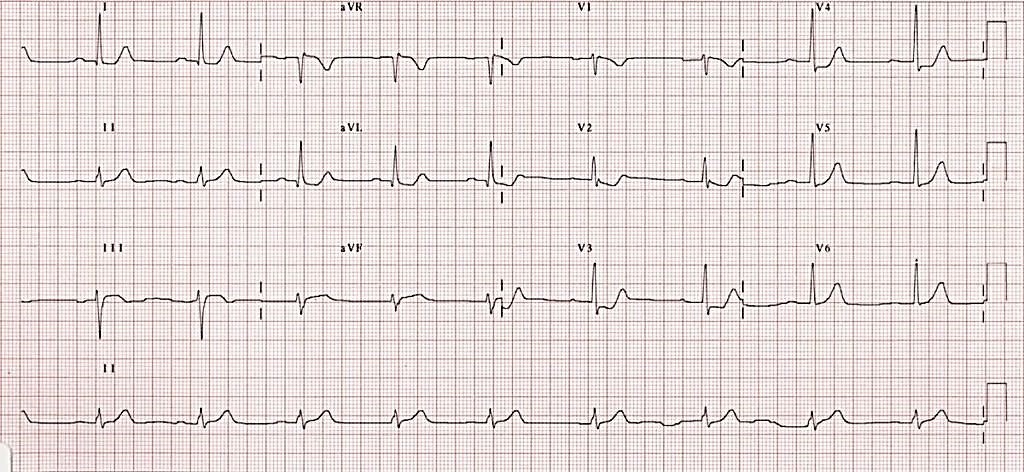
Подібним чином, якщо початкова ЕКГ показує ознаки STEMI нижньої стінки ЛШ (елевація ST у відведеннях II, III та aVF з реципрокними змінами), тоді слід розмістити електроди V1-V6 на грудній клітці пацієнта в дзеркальному порядку (як показано на Малюнку 14). Якщо ці відведення (що тепер називаються V1R-V6R) показують елевацію сегмента ST, це буде означати наявність інфаркту міокарда правого шлуночка.
Малюнок 14. Розташування електродів для запису правих відведень ЕКГ 33
Якщо початкова ЕКГ є недіагностичною (тобто лише одне відведення відповідає критеріям елевації ST, а елевація ST у другому суміжному відведенні менше 0,1 мВ), але є підозра на ГКС, то варто провести серійні ЕКГ-дослідження (кожні 15 хвилин протягом першої години), щоб не пропустити STEMI.17,19
На відміну від STEMI, нестабільна стенокардія/NSTEMI може проявлятися різноманітними змінами на ЕКГ. Вони можуть включати незмінену ЕКГ, неспецифічні інвертовані зубці Т, депресію ST або транзиторну елевацію ST.
Лікування
Медикаментозна терапія
Початкова медикаментозна терапія ГКС включає швидке введення антиагрегантів, антикоагулянтів та реваскуляризаційну терапію, включаючи фібринолітичну терапію (якщо немає протипоказів і ЧКВ не доступне негайно). Наведені нижче розділи містять списки поширених доступних ліків кожного класу препаратів.
Антиагрегантна терапія
Усім пацієнтам із підозрою на ГКС слід негайно призначити аспірин, якщо немає протипоказів. Після того, як діагноз ГКС встановлено, має бути призначений інгібітор рецепторів АДФ тромбоцитів (P2Y), наприклад, клопідогрель чи тикагрелор, якщо немає протипоказань.12 Початкове дозування для всіх препаратів наведено нижче.
- Аспірин 162 – 325 мг перорально (ПО) x 1 раз (бажано аспірин для розжовування; якщо він недоступний, використовуйте аспірин без кишковорозчинної оболонки), потім 81 мг ПО щодня.
ПЛЮС
- Клопідогрель (Плавікс)
- Вік ≤ 75 років: початкова навантажувальна доза 300 мг ПО x 1 раз, потім 75 мг ПО щодня.
- Вік > 75 років: початкова доза 75 мг ПО x 1 раз, потім 75 мг ПО щодня.
АБО
- Тікагрелор (Брилінта) 180 мг ПО x1 раз, потім 90 мг двічі на день.
Важливо зазначити, що тікагрелор може викликати задишку, яка вважається доброякісною, хоча іноді викликає занепокоєння у пацієнта/клініциста.
Антикоагулянтна терапія
Системну антикоагулянтну терапію слід призначити відразу після встановлення діагнозу ГКС, якщо немає протипоказань. Варіанти антикоагулянтів включають нефракціонований гепарин і низькомолекулярний гепарин (НМГ) (наприклад, еноксапарин), які проявляють свої антикоагулянтні властивості шляхом непрямого інгібування тромбіну. Іншим варіантом є інгібітор фактора Ха (наприклад, фондапаринукс). Гепарин вводять у вигляді болюсу з подальшим крапельним введенням, і його ефект контролюється за допомогою визначення активованого часткового тромбопластинового часу (aЧТЧ). Наразі бригади CCAT, які транспортують пацієнтів із місця ведення бойових дій, не мають можливості контролювати аЧТЧ при краплинній інфузії гепарину. Тому, коли потрібне транспортування, перевага над краплинним введенням гепарину віддається еноксапарину, враховуючи легкість його використання. Якщо еноксапарин або інший НМГ недоступний, слід розглянути можливість застосування фондапаринуксу, якщо він доступний. Якщо гепарин є єдиним доступним засобом, слід вводити його. Дозування при транспортуванні буде розраховуватись на основі аЧТЧ, визначеного безпосередньо перед польотом. Пацієнтам з відомою або підозрюваною гепарин-індукованою тромбоцитопенією в анамнезі слід застосовувати фондапаринукс. Антикоагулянтну терапію слід продовжувати щонайменше 48 годин або до реваскуляризації.
Нижче наведено дозування для кожного препарату:
- Еноксапарин (Lovenox) – препарат вибору
- Дозування при STEMI:
- Вік < 75 років: одноразово 30 мг ВВ болюсно плюс 1 мг/кг підшкірно (максимум 100 мг лише для перших 2 доз), потім 1 мг/кг підшкірно кожні 12 годин
- Вік ≥ 75 років: 0,75 мг/кг підшкірно кожні 12 годин
- NSTEMI дозування: 1 мг/кг підшкірно кожні 12 годин.
- Проконсультуйтесь з фармацевтом, щоб скорегувати цю дозу, якщо є ураження нирок (підвищення креатиніну).
АБО
- Гепарину сульфат
- Дозування при STEMI: 60 ОД/кг початковий болюс ВВ (4000 ОД максимум), потім 12 ОД/кг/год (максимум 1000 ОД/год) в інфузії.
Підтримуйте аЧТЧ у 1,5–2,0 рази вище норми (50–70 с). - Дозування при NSTEMI: 60 ОД/кг початковий болюс ВВ (5000 ОД максимум), потім 12 ОД/кг/год (максимум 1000 ОД/год) в інфузії.
Підтримуйте АЧТЧ у 1,5–2,0 рази вище норми (50–70 с).
АБО
- Фондапаринукс (Арикстра)
- Дозування при STEMI: 2,5 мг ВВ x1 раз, потім 2,5 мг ПШ щодня.
- Дозування при NSTEMI: 2,5 мг ПШ щодня.
Реперфузійна терапія
Невідкладна реперфузія є основою лікування STEMI. Коли це можливо, пацієнта зі STEMI слід терміново доставити до найближчого медичного закладу, де можна виконати термінове ЧКВ, оскільки це вважається оптимальним лікуванням. ЧКВ має бути проведено в межах 2 годин після прибуття пацієнта.13 Якщо період «від дверей до балона» не може бути меншим 2 годин,тоді слід ввести фібринолітики. В умовах розгорнутих бойових дій ЧКВ може бути надто далеко, тому швидке проведення фібринолітичної терапії є методом вибору для реваскуляризації. Фібринолітичну терапію слід проводити в межах 30 хвилин після встановлення діагнозу STEMI. Існують абсолютні та відносні протипокази до застосування фібринолітиків (наведені в Додатку А). Їх перелік слід ретельно переглянути пункт за пунктом перед введенням фібринолітиків. Нижче наведено два найпоширеніші препарати та їх дозування. Фібринолітики слід застосовувати пацієнтам із тривалістю симптомів 12 годин або менше. Якщо розглядається введення фібринолітиків у період від 12 до 24 годин, то перед їх введенням рекомендується отримати консультацію лікаря-кардіолога.
Примітка: Подвійна антитромбоцитарна терапія, системна антикоагуляція, бета-блокатори та високодозові статини все одно повинні призначатися навіть при застосуванні фібринолітиків.
- Тенектеплаза (TNKase) – препарат вибору
- < 60 кг: 30 мг ВВ болюсно х1 раз
- 60-69 кг: 35 мг ВВ болюсно х1 раз
- 70-79 кг: 40 мг ВВ болюсно х1 раз
- 80-89 кг: 45 мг ВВ болюсно х1 раз
- ≥ 90 кг: 50 мг ВВ болюсно х1 раз
АБО
- Альтеплаза (Activase)
- ≤ 67 кг: 15 мг ВВ болюсно протягом 1-2 хвилин, потім інфузія 0,75 мг/кг (максимум 50 мг) протягом 30 хвилин, потім інфузія 0,5 мг/кг (максимум 35 мг) протягом 60 хвилин.
- 67 кг і більше: 15 мг ВВ болюсно протягом 1-2 хвилин, потім інфузія 50 мг протягом 30 хвилин, потім інфузія 35 мг протягом 60 хвилин (максимальна загальна доза 100 мг).
Примітка: На відміну від STEMI, фібринолітики протипоказані пацієнтам з нестабільною стенокардією/NSTEMI.
Терапія статинами
Високі дози статинів слід призначати під час початкових проявів (в межах перших 2 годин) ГКС незалежно від рівня ліпідів у крові пацієнта. Нижче наведено два варіанти терапії:
- Аторвастатин (Lipitor) 80 мг ПО 1 раз, потім 80 мг на ніч.
АБО
- Розувастатин (Crestor) 20-40 мг ПО x1 раз, потім 20-40 мг ПО щодня.
Підтримуюча терапія
Додатковий кисень
Надавати додатковий кисень пацієнтам з ГКС рекомендується тільки при сатурації < 90%, щоб уникнути потенційної шкоди від вільних радикалів кисню та подальшого звуження коронарних судин внаслідок гіпероксії.
Знеболення
Зниження больової реакції може блокувати симпатичну активність і зменшити тривогу, яка погіршує споживання кисню міокардом. Рутинне застосування морфіну для контролю болю не рекомендується, оскільки було показано, що це підвищує ризик смертності при ГКС.34 Нітрогліцерин є судинорозширювальним засобом, що відкриває кровоносні судини для поліпшення кровотоку; він полегшує симптоми стенокардії, такі як біль або важкість у грудях, що виникли внаслідок недостатнього кровопостачання серця. Нітрогліцерин розширює коронарні артерії та розслаблює гладкі м’язи судин, що призводить до зменшення перед-/післянавантаження та зниження потреби міокарда в кисні.
Нітрогліцерин
- Початкова доза 0,3 – 0,4 мг сублінгвально кожні 5 хвилин 3 рази; після цього можна розглянути можливість призначення ВВ інфузії.
- Якщо проводиться ВВ інфузія нітрогліцерину, починайте з 5-10 мкг/хв і титруйте за потреби до полегшення симптомів стенокардії з кроком 5 мкг/хв кожні 5-10 хв до 20 мкг/хв; якщо стенокардія зберігається при дозі 20 мкг/хв, збільшуйте дозу на 10-20 мкг/хв кожні 3-5 хвилин до максимальної дози 400 мкг/хв.
- Нітрогліцерин протипоказаний пацієнтам із систолічним артеріальним тиском < 100 мм рт.ст., тим, хто приймав інгібітори фосфодіестерази протягом останніх 24 годин, а також пацієнтам з ознаками STEMI нижньої стінки ЛШ на ЕКГ.
Бета-блокатори
Бета-блокатори пригнічують симпатичну стимуляцію і знижують частоту серцевих скорочень. Було показано, що вони зменшують ризик раннього розвитку летальних шлуночкових аритмій, а також покращують довготривале ремоделювання лівого шлуночка. Незважаючи на те, що Американська кардіологічна асоціація та Американський коледж кардіології рекомендують починати прийом бета-блокаторів у перші 24 години NSTEMI, були проведені дослідження, які показали, що раннє застосування бета-блокаторів у відділенні екстреної/невідкладної допомоги було пов’язане з вищим рівнем шоку або смерті, ніж пізніше їх призначення.35 Призначайте бета-блокатори після того, як пацієнт був госпіталізований у заклад другого або третього етапу медичної допомоги. Не слід використовувати бета-блокатори у пацієнтів із систолічним артеріальним тиском < 100 мм рт., ЧСС < 60 уд/хв, ознаками набряку легень, AV-блокадою ІІ чи ІІІ ступеня, бронхообструктивним синдромом або підвищеним ризиком кардіогенного шоку.
- Метопрололу тартрат (негайної дії) – 12,5 мг ПО кожні 6 – 12 годин.
АБО
- Метопрололу сукцинат (пролонгованої дії) – 25-50 мг ПО 1 раз на добу.
АБО
- Атенолол – 50-100 мг ПО кожні 12-24 години.
Інгібітори АПФ та БРА
Інгібітори ангіотензин-перетворюючого ферменту (АПФ), які починають застосовувати протягом 24 годин – 16 днів після гострого ІМ, демонструють покращене виживання пацієнтів, а також покращену фракцію викиду лівого шлуночка. Інгібітори АПФ протипоказані при систолічному артеріальному тиску < 100 мм рт.ст., двосторонньому стенозі ниркової артерії в анамнезі, гіперкаліємії або попередньому погіршенні функції нирок при застосуванні інгібіторів АПФ. Пацієнтам з непереносимістю інгібіторів АПФ доцільно призначати блокатори рецепторів ангіотензину (БРА).
- Каптоприл - початкова доза 6,25 мг ПО, яку збільшують кожні 6-8 годин до максимальної дози 50 мг ПО тричі на день, доки систолічний артеріальний тиск перевищує 90-100 мм рт.
АБО
- Еналаприл - початкова доза 2,5 мг ПО щодня, яку збільшують до 20 мг ПО двічі на день.
АБО
- Лізиноприл - початкова доза 2,5 мг ПО щодня, яку збільшують до максимальної дози 10 мг ПО щодня.
АБО
- Лозартан - 25-50 мг ПО 1 раз на добу залежно від початкового артеріального тиску.
Інші препарати
Якщо є покази, продовжуйте використовувати інгібітори протонної помпи. З іншого боку, слід уникати використання нестероїдних протизапальних препаратів (НПЗП) у цих пацієнтів через підвищений ризик несприятливих серцево-судинних подій і підвищений ризик кровотечі, зважаючи на інші основні методи лікування ГКС, такими як антитромбоцитарна та антикоагулянтна терапія. Рутинне проведення гемотрансфузії при ГКС пов’язане зі збільшенням смертності.13,36,37 Рекомендується уникати переливання крові, якщо рівень гемоглобіну є вищим 80 г/л.
Ускладнення лікування
Кровотеча
Кровотечі як ускладнення є доволі рідкісними, але вони можуть виникнути, тому за цим слід уважно стежити. Неврологічний огляд слід проводити кожні 15 хвилин протягом першої години, а потім кожні 30 хвилин протягом наступних 6 годин з метою виявлення внутрішньочерепної кровотечі. Слід прагнути до нормотензії, уникаючи САТ > 160 мм рт. Після виявлення кровотечі, що загрожує життю, припиніть введення усіх антиагрегантів, антикоагулянтів та фібринолітиків. Нижче наведено специфічні препарати, що застосовуються у випадку загрозливих для життя кровотеч, які виникли внаслідок тромболізису.38 У разі підозри на внутрішньочерепну кровотечу негайно проведіть КТ голови та, якщо виявлена внутрішньочерепна кровотеча, проконсультуйтесь з нейрохірургом.
- Введіть кріопреципітат - 10 од. ВВ.
- Введіть транексамову кислоту - 10-15 мг/кг ВВ.
- Припиніть введення усіх антиагрегантів, антикоагулянтів і фібринолітиків.
Ускладнення, пов’язані з ІМ
Існують ранні та пізні ускладнення, пов’язані з ІМ. Ми зосередимось на ранніх ускладненнях, оскільки протягом перших годин або днів лікування в умовах бойових дій ви зустрічатиметесь саме з ними.
Кардіогенний шок
Кардіогенний шок визначається як САТ < 90 мм рт. ст. протягом 30 хвилин або САТ > 90 мм рт. ст. при використанні вазопресорів, у поєднанні з ознаками ураження органів-мішеней внаслідок серцево-судинних порушень. У пацієнта можуть бути ознаки набряку легень (задишка, що прогресує, хрипи, негативна динаміка на рентгенограмі грудної клітки) або ознаки периферичної гіпоперфузії (слабкий пульс, холодні кінцівки). Нижче наведено вазопресорні/інотропні засоби, які слід використовувати в такому випадку.39
- Норадреналін (рекомендований препарат першої лінії) - 5–20 мкг/хв ВВ. Почніть з 5 мкг/хв і збільшуйте на 2-5 мкг/хв кожні 15 хвилин.
- Допамін - від 0,5 до 20 мкг/кг/хв ВВ (бажано використовувати менші дози).
Механічні ускладнення
Механічні ускладнення в основному проявляються у вигляді гострого розриву хорди мітрального клапана, розриву міжшлуночкової перегородки або розриву вільної стінки лівого шлуночка. Зазвичай, вони виникають в межах перших 24 годин, але можуть проявитися і протягом першого тижня. Застосування фібринолітиків також є фактором ризику гострого розриву міжшлуночкової перегородки та розриву вільної стінки лівого шлуночка. Медикаментозна терапія є лише тимчасовим заходом. У тих, кому неможливо провести хірургічну корекцію, спостерігається високий рівень смертності. Ехокардіографія є методом вибору для швидкої діагностики. За допомогою ЕхоКГ можна виявити рідину в перикарді внаслідок розриву вільної стінки лівого шлуночка.
Аритмії
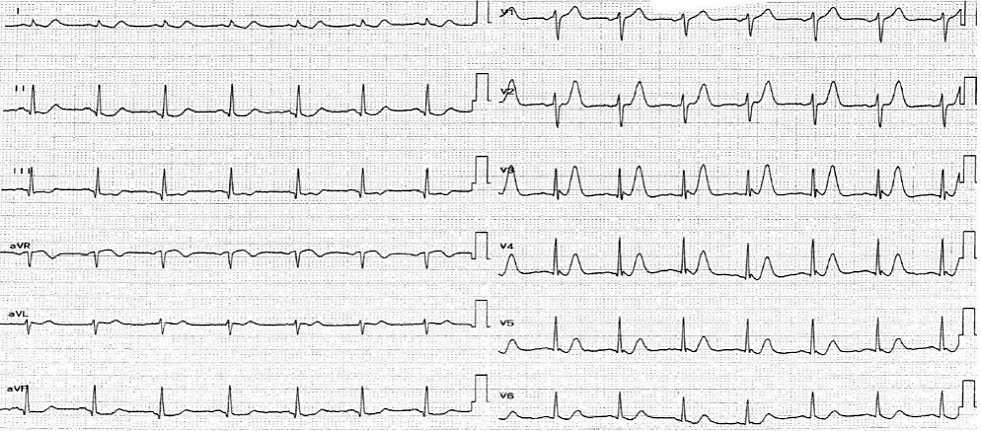
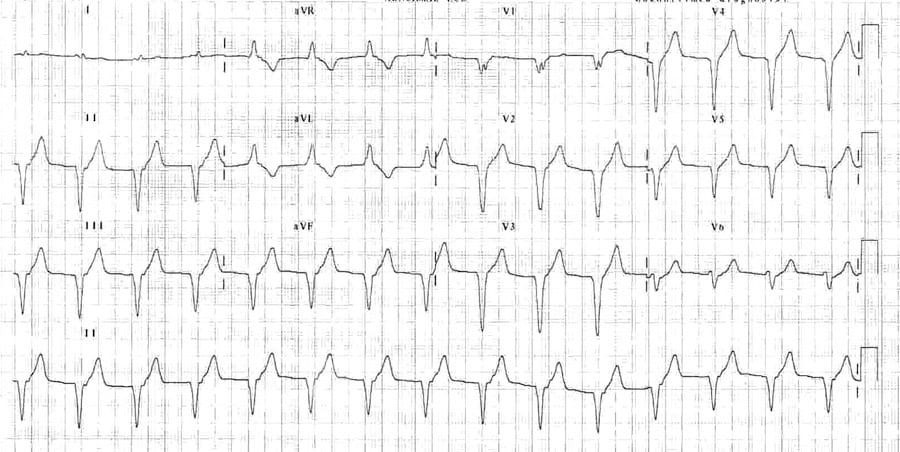
Існує багато видів тахі- та брадиаритмій, які можуть виникати при гострому ІМ. З більшістю з них можна впоратися за допомогою протоколів ACLS. Найбільш поширеним порушенням ритму після реперфузії є прискорений ідіовентрикулярний ритм (Мал. 14). Він виглядає як ритм з широкими комплексами QRS (як і при шлуночковій тахікардії) із частотою серцевих скорочень 50–110 ударів на хвилину; він є доброякісним і не потребує втручання.40 Пацієнти, як правило, є безсимптомними з нормальними показниками життєвих функцій. Такий ритм припиняється спонтанно.
Малюнок 15. ЕКГ у 12 відведеннях: STEMI; прискорений ідіовентрикулярний ритм після реперфузії40
Особливості проведення ШВЛ
Медикаменти
Якщо у пацієнта з ГКС розвивається шок, і є загроза порушення прохідності дихальних шляхів, вам, можливо, доведеться виконати ендотрахеальну інтубацію (див. Настанови з клінічної практики “Забезпечення прохідності дихальних шляхів” - Airway Management CPG). При використанні препаратів для індукції та постінтубаційної седації слід враховувати наступне:41
- Кетамін: слід уникати його використання пацієнтам із гострим ІМ або серцевою недостатністю через підвищене споживання кисню міокардом та негативний інотропний ефект.
- Етомідат рекомендований для індукції анестезії з огляду на його нейтральний вплив на гемодинаміку.
- Пропофол при індукції слід застосовувати з обережністю, враховуючи його здатність викликати гостру артеріальну гіпотензію. Загалом, він безпечний для підтримки анестезії, однак слід бути обережним у пацієнтів із тяжкими серцевими захворюваннями, оскільки було показано, що пропофол також загострює серцеву дисфункцію через свій негативний інотропний ефект.
- Мідазолам/Фентаніл можна використовувати для індукції/підтримки анестезії.
Налаштування апарата ШВЛ
Високий внутрішньогрудний тиск по-різному впливає на правий і лівий шлуночок. Високий внутрішньогрудний тиск погіршує наповнення правого шлуночка, але зменшує післянавантаження на лівий шлуночок. У пацієнтів після ІМ, які потребують ШВЛ, мінімізація внутрішньогрудного тиску в пацієнта з інфарктом нижньої стінки ЛШ або правого шлуночка має дуже важливе значення для підтримки серцевого викиду. Позитивний тиск у кінці видиху (ПТКВ) і дихальний об’єм повинні бути мінімізовані, наскільки це можливо.
Особливості проведення евакуації
Лікування пацієнтів з ГКС в умовах бойових дій обмежене тим, що кардіологічна допомога надається в непристосованих умовах, без швидкого доступу до вищого рівня медичної допомоги. У той час як медикаментозне лікування може стабілізувати стан пацієнтів на короткий період часу, воно не може замінити невідкладного/екстреного лікування в катетеризаційній лабораторії у випадку виникнення будь-яких ускладнень. Запит на невідкладну наземну (MEDEVAC)/аеромедичну евакуацію до центру з можливістю проведення ЧКВ має бути поданий, як тільки пацієнту буде поставлено діагноз ГКС та розпочато медичне лікування.
Телемедична/кардіологічна консультація
В умовах розгорнутих бойових дій стосовно пацієнтів з діагнозом STEMI або нестабільної стенокардії/NSTEMI слід негайно проконсультуватися з першим консультантом-кардіологом у ланцюжку евакуації. Діагностика та лікування ГКС має здійснюватися на основі консультації експерта, включаючи електронну передачу ЕКГ (у будь-який доступний спосіб).
MEDEVAC
Якщо можливо, усіх пацієнтів з діагнозом ГКС або з високою підозрою на ГКС на першому або другому етапі медичної допомоги слід якомога швидше перевести у заклад третього етапу надання допомоги (бажано в заклад, де є кардіолог).
Приймаюча країна
Іноді приймаючі країни мають медичні заклади, які відповідають стандартам США щодо медичного обслуговування. Якщо з цими закладами встановлені належні відносини, та вони вже використовувалися для надання екстреної допомоги військовослужбовцям США, то слід розглянути варіант звернення в такі заклади для проведення екстреного ЧКВ у таких ситуаціях:
- STEMI – ЧКВ у закладі приймаючої країни має перевагу перед фібринолізом, оскільки ЧКВ - це основне лікування при STEMI. Якщо загальний час транспортування до закладу перевищує 120 хвилин, проведіть фібриноліз (з телеконсультацією кардіолога) і продовжуйте координувати транспортування до лабораторії ЧКВ приймаючої країни.
- Нестабільна стенокардія/NSTEMI – рефрактерна стенокардія, ішемічні зміни на ЕКГ, гемодинамічна нестабільність (з кардіогенним шоком або без) або рефрактерні аритмії після медикаментозної терапії.
Аеромедична евакуація
Аеромедична евакуація всіх пацієнтів з гострим коронарним синдромом має проводитись згідно з наступними принципами, коли це можливо, зважаючи на характерний перебіг захворювання та обмежені можливості повністю впоратися з ускладненнями.
- Усі пацієнти з ГКС повинні евакуюватись бригадою CCAT або командою еквівалентного рівня.
- Запит на евакуацію має подаватися як НЕВІДКЛАДНИЙ (за винятком, якщо під час консультації кардіолога рекомендована інша категорія).
- Надання допомоги під час польоту повинне відповідати рекомендаціям, описаним у попередніх розділах даних настанов.
Особливості надання допомоги під час польоту
- Підтримуйте сатурацію крові О2 > 90%.
- Слід уникати переливання еритроцитів, якщо рівень гемоглобіну більше 80 г/л у пацієнтів без активної ішемії.13,36
- У разі виникнення STEMI під час польоту (новий або повторний інфаркт) слід призначити тромболітики, якщо немає протипоказів (див. Додаток А).
- Якщо стан пацієнта стає нестабільним під час польоту, слід розглянути питання про екстрену посадку найближче до лікувального закладу з можливостями ЧКВ. Нестабільний пацієнт – це той, у якого зберігається ішемія у поєднанні з одним із нижче наведених станів:
- Артеріальна гіпотензія/шок внаслідок підозрюваних серцево-судинних порушень.
- Рецидивуючі шлуночкові аритмії, які неможливо контролювати за допомогою препаратів ACLS (наприклад, бета-блокаторів, аміодарону).
Моніторинг покращення ефективності (ПЕ)
Досліджувана група
- Усі пацієнти зі STEMI, яким була призначена подвійна антитромбоцитарна терапія, системна антикоагулянтна та фібринолітична терапія (за винятком протипоказів) в межах 30 хвилин після прибуття до закладу, де ця терапія доступна.
- У закладах, де немає фібринолітиків, перед переведенням на вищий рівень допомоги призначається подвійна антиагрегантна терапія та системна антикоагуляція.
Мета (очікувані результати)
- Усі пацієнти з підозрою на STEMI або NSTEMI повинні мати задокументовану консультацію/телеконсультацію з кардіологом.
- Усіх пацієнтів з діагнозом STEMI переводять у центр проведення ЧКВ.
Показники результативності/Дотримання рекомендацій
- Подвійна антитромбоцитарна терапія та системна антикоагуляція проводяться в межах 30 хвилин після прибуття до закладу, де ці методи лікування доступні.
- Фібринолітична терапія проводиться в межах 30 хвилин після підтвердження STEMI у закладах, де такий метод є доступним; або час “від дверей до центру проведення ЧКВ” є менше 120 хвилин для закладів, які можуть організувати переведення до центру проведення ЧКВ.
- Консультація/телеконсультація з кардіологом задокументована у всіх пацієнтів з підозрою на STEMI або NSTEMI.
Джерела даних
- Медична картка пацієнта
- Реєстр травм Департаменту оборони США
- Реєстр медичних даних театру бойових дій
Системна звітність та її частота
Згідно з даними настановами, вказане вище становить мінімальні критерії моніторингу ПЕ. Системна звітність проводитиметься щороку; додатковий моніторинг ПЕ та системну звітність можна проводити залежно від потреб.
Системний огляд та аналіз даних виконуватиме керівник Об’єднаної системи лікування травм (JTS) та відділ ПЕ JTS.
Обов’язки
Керівник команди з надання допомоги при травмах відповідає за ознайомлення з даними Настановами з клінічної практики, належне дотримання вказаних у ній вимог та моніторинг ПЕ на місцевому рівні.
-
- Heron M. Deaths: Leading causes for 2017. Natl Vital Stat Rep 2019;68:1-77.
- The Top 10 Causes of Death. 2018 https://www.who.int/news-room/fact-sheets/detail/the-top-10-causes-of-death
- Shrestha A, Ho TE, Loryana L. et al. Comparison of cardiovascular health between U.S. Army and Civilians. J Am Heart Assoc. Originally published 5 Jun 2019. https://doi.org/10.1161/JAHA.118.009056Journal of the American Heart Association. 2019;8:e009056.
- 2019 Health of the Force. 2019. https://phc.amedd.army.mil/PHC%20Resource%20Library/2019_Health-of-the-Forcewebenhanced.pdf
- Osula S, Bell GM, Hornung RS. Acute myocardial infarction in young adults: causes and management. Postgraduate Medical Journal 2002;78:27-30.
- Webber BJ, Seguin PG, Burnett DG, et al. Prevalence of and risk factors for autopsy-determined atherosclerosis among US service members, 2001-2011. Jama 2012;308:2577-83.
- Galvagno SM, Dubose JJ, Grissom TE, et al. The epidemiology of Critical Care Air Transport Team operations in contemporary warfare. Mil Med 2014;179:612-8.
- Sweis RN, Jivan A. Acute coronary syndrome: Terminology and classification. Merck Manual 2020. https://www.merckmanuals.com/professional/cardiovascular-disorders/coronary-arterydisease/overview-of-acute-coronary-syndromes-acs
- Tintinalli JE, Ma OJ, Yealy DM, et al. Tintinalli's Emergency medicine: a comprehensive study guide, 9e. https://accessmedicine.mhmedical.com/book.aspx?bookID=2353 Accessed May 2021.
- Walls RM, Hockberger RS, Gausche-Hill M. Rosen's emergency medicine: concepts and clinical practice. Elsevier, 2018.
- Gu D, Qu J, Zhang H, Zheng Z. Revascularization for coronary artery disease: Principle and challenges. Adv Exp Med Biol 2020;1177:75-100.
- Steinberg JS, Hochman JS, Morgan CD, et al. Effects of thrombolytic therapy administered 6 to 24 hours after myocardial infarction on the signal-averaged ECG. Results of a multicenter randomized trial. LATE Ancillary Study Investigators. Late assessment of thrombolytic efficacy. Circulation 1994;90:746-52.
- O'Gara PT, Kushner FG, Ascheim DD, et al. The American College of Cardiology Foundation/American Heart Association guideline for the management of ST-elevation myocardial infarction: executive summary. Circulation. 2013;127:529–555 https://www.ahajournals.org/doi/10.1161/CIR.0b013e3182742c84 Accessed May 2021.
- McManus DD, Gore J, Yarzebski J, Spencer F, Lessard D, Goldberg RJ. Recent trends in the incidence, treatment, and outcomes of patients with STEMI and NSTEMI. Am J Med 2011;124:40-7.
- Khan AR, Golwala H, Tripathi A, et al. Impact of total occlusion of culprit artery in acute non-ST elevation myocardial infarction: a systematic review and meta-analysis. Eur Heart J 2017;38:3082-9.
- Canto JG, Shlipak MG, Rogers WJ, et al. Prevalence, clinical characteristics, and mortality among patients with myocardial infarction presenting without chest pain. Jama 2000;283:3223-9.
- Thygesen K, Alpert JS, Jaffe AS, et al. Third universal definition of myocardial infarction. Glob Heart 2012;7:275-95.
- Amsterdam EA, Wenger NK, Brindis RG, et al. The American College of Cardiology Foundation/American Heart Association guideline for the management of patients with non-STelevation acute coronary syndromes: executive summary. Circulation 2014;130:2354-94.
- Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018). Circulation 2018;138:e618-e51.
- 12-Lead ECG placement guide with illustrations https://www.cablesandsensors.com/pages/12-leadecg-placement-guide-with-illustrations Accessed May 2021..
- Anterior Myocardial Infarction. 2019. https://litfl.com/anterior-myocardial-infarction-ecg-library/ Accessed May 2021.
- Inferior STEMI. 2019. https://litfl.com/inferior-stemi-ecg-library/ Accessed May 2021.
- Lateral STEMI. 2019. https://litfl.com/lateral-stemi-ecg-library/ Accessed May 2021.
- Meyers PH, Smith SW. Acute coronary syndromes. In: Mattu A and Swadron S, ed. CorePendium. Burbank, CA: CorePendium, LLC. https://www.emrap.org/corependium/chapter/rec8tYnfjz2FpdGrE/Acute-Coronary-Syndromes. Updated April 23, 2021. Accessed May 18, 2021.
- Goldberger, AL. Electrocardiographic diagnosis of myocardial infarction in the presence of bundle branch block or a paced rhythm. Updated 13 Oct 2020. https://www.uptodate.com/contents/electrocardiographic-diagnosis-of-myocardial-infarction-inthe-presence-of-bundle-branch-block-or-a-paced-rhythm Accessed May 2021.
- Smith SW, Dodd KW, Henry TD, et al. Diagnosis of ST-elevation myocardial infarction in the presence of left bundle branch block with the ST-elevation to S-wave ratio in a modified Sgarbossa rule. Ann Emerg Med 2012;60:766-76.
- Burns E, Buttner R. De Winter T Wave. 27 Apr 2021. https://litfl.com/de-winter-t-wave-ecg-library/ Accessed May 2021.
- Burns E, Buttner R. ST elevation in aVR. 05 Apr 2021 https://litfl.com/lmca-occlusion-st-elevation-inavr/ Accessed May 2021.
- Zarama V, Adams CD, Vesga CE. A patient with chest pain and hyperacute T Waves. Chest 2018;154:e161-e4.
- Cadogan M. Wellens Syndrome. 2021. https://litfl.com/wellens-syndrome-ecg-library/
- Burns E. Posterior myocardial infarction. 04 Feb 2021.https://litfl.com/posterior-myocardialinfarction-ecg-library/ Accessed May 2021.
- Winter, J. Posterior ECG lead placement. 2016. https://ecgeducator.blogspot.com/2016/02/posterior-ecg-lead-placement.html Accessed May 2021.
- Burns E, Buttner R. Right Ventricular Infarction. 2021. https://litfl.com/right-ventricular-infarctionecg-library/ Accessed May 2021.
- Meine TJ, Roe MT, Chen AY, et al. Association of intravenous morphine use and outcomes in acute coronary syndromes: results from the CRUSADE Quality Improvement Initiative. Am Heart J 2005;149:1043-9.
- Kontos MC, Diercks DB, Ho PM, et al. Treatment and outcomes in patients with myocardial infarction treated with acute β-blocker therapy: results from the American College of Cardiology's NCDR(®). Am Heart J 2011;161:864-70.
- Rao SV, Jollis JG, Harrington RA, et al. Relationship of blood transfusion and clinical outcomes in patients with acute coronary syndromes. Jama 2004;292:1555-62.
- Aronson D, Dann EJ, Bonstein L, et al. Impact of red blood cell transfusion on clinical outcomes in patients with acute myocardial infarction. Am J Cardiol. 2008 Jul 15;102(2):115-9.
- Dastur CK, Yu W. Current management of spontaneous intracerebral haemorrhage. Stroke Vasc Neurol 2017;2:21-9.
- van Diepen S, Katz JN, Albert NM, et al. Contemporary management of cardiogenic shock: a scientific statement from the American Heart Association. Circulation 2017;136:e232-e68.
- Burns, E. Accelerated Idioventricular Rhythm (AIVR). 04 Feb 2021. https://litfl.com/acceleratedidioventricular-rhythm-aivr/ Accessed May 2021.
- Page RL, 2nd, O'Bryant CL, Cheng D, et al. Drugs that may cause or exacerbate heart failure: a scientific statement from the American Heart Association. Circulation 2016;134:e32-69.
Додаток А: Фібринолітики. Абсолютні та відносні протипокази при STEMI
У таблиці наведені абсолютні та відносні протипокази за станом здоров’я щодо введення фібринолітиків при STEMI.
Таблиця A-1. Абсолютні та відносні протипокази
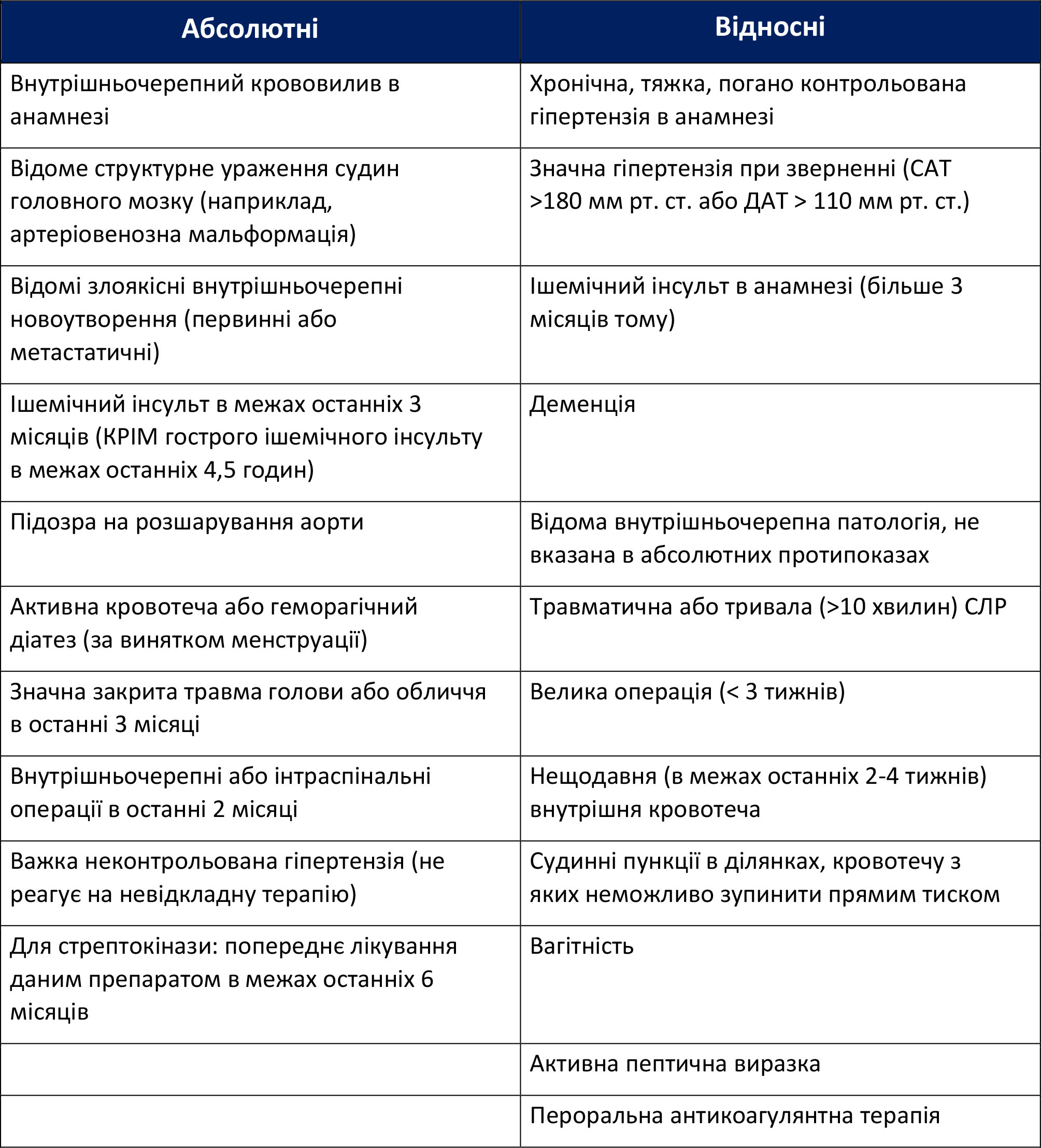
Джерело: O'Gara PT, Kushner FG, Ascheim DD, et al. The American College of Cardiology Foundation/American Heart Association guideline for the management of ST-elevation myocardial infarction: executive summary. Circulation. 2013;127:529–555 https://www.ahajournals.org/doi/10.1161/CIR.0b013e3182742c84 Доступ отримано в травні 2021.
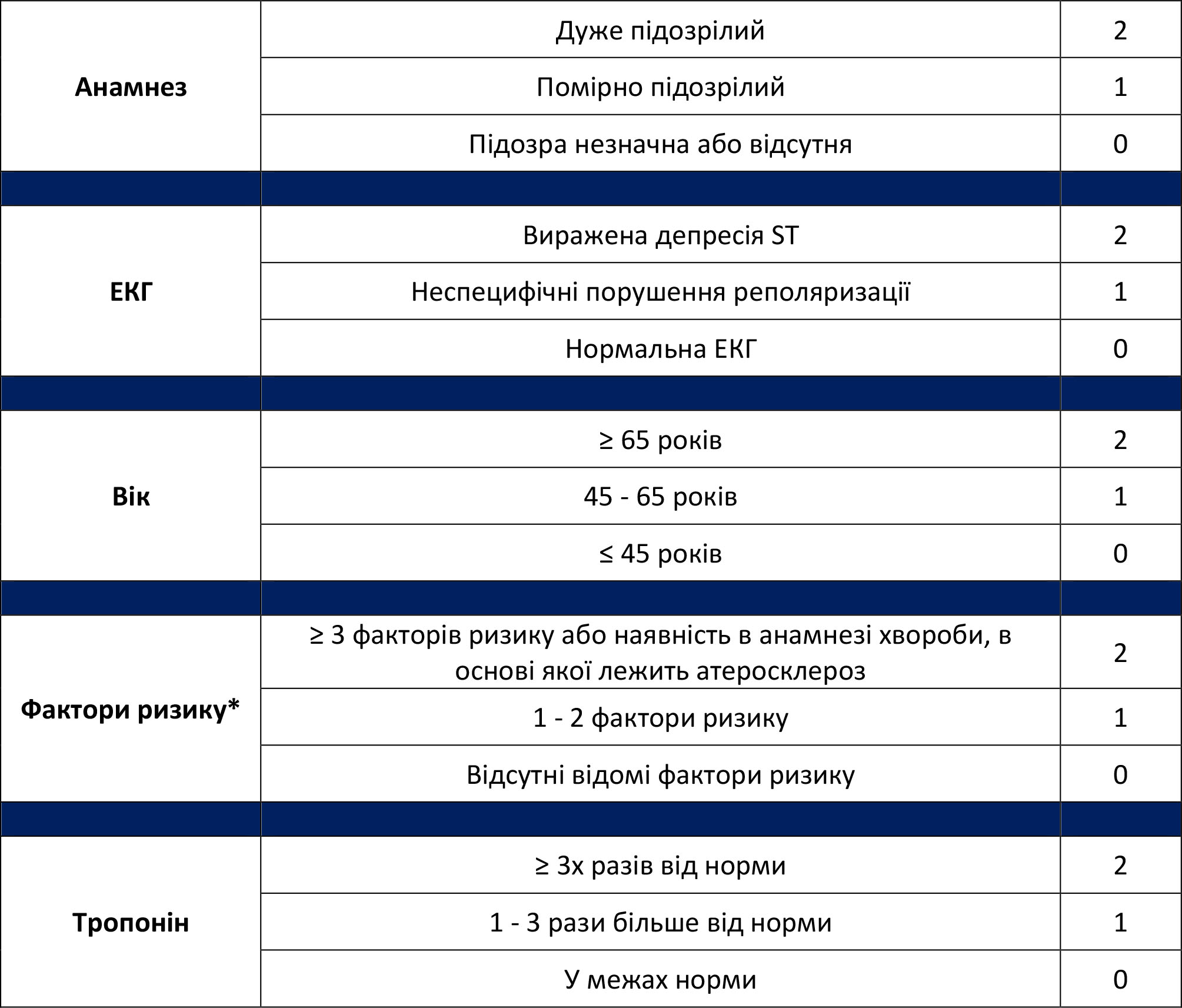
Додаток B: Шкала HEART для значних несприятливих серцевих подій
У цьому додатку наведено шкалу HEART для прогнозу ризику значних несприятливих серцевих подій (Major Adverse Cardiac Event - MACE) протягом наступних 6 тижнів.
До значних несприятливих серцевих подій належать:
- Гострий інфаркт міокарда (ІМ)
- Черезшкірне коронарне втручання (ЧКВ)
- Аортокоронарне шунтування (АКШ)
- Коронарна ангіографія з виявленням стенозів, які піддаються процедурній корекції, лікованих консервативно
- Смерть з будь-якої причини
Таблиця B-1. Шкала HEART для значних несприятливих серцевих подій
Нижче наведено фактори ризику MACE:
- Гіпертензія
- Гіперхолестеринемія
- Цукровий діабет
- Ожиріння (ІМТ > 30 кг/м2)
- Куріння (у даний момент або припинення куріння < 1 місяця)
- Наявність сімейного анамнезу щодо ішемічної хвороби серця
- Атеросклеротична хвороба
- ІМ, ЧКВ, АКШ, порушення мозкового кровообігу/транзиторна ішемічна атака або захворювання периферичних артерій в анамнезі
Нижче наведена частота значних несприятливих серцевих подій залежно від балів:
- 0 – 3: низький ризик; У 1,7% виявлено значні несприятливі серцеві події
- 4 – 6: помірний ризик; У 16,6% виявлено значні несприятливі серцеві події
- 7 – 10: високий ризик; У 50,1% виявлено значні несприятливі серцеві події
Джерела:
- Backus BE, Six AJ, Kelder JC, et al. A prospective validation of the HEART score for chest pain patients at the emergency department. Int J Cardiol 2013;168:2153-8.
- Backus BE, Six AJ, Kelder JC, et al. Chest pain in the emergency room: a multicenter validation of the HEART Score. Crit Pathw Cardiol 2010;9:164-9.
- Six AJ, Backus BE, Kelder JC. Chest pain in the emergency room: value of the HEART score. Neth Heart J 2008;16:191-6.
Додаток C: Надання медичної допомоги при ГКС на різних етапах
На схемах представлено надання медичної допомоги при ГКС на різних етапах.
Схема C-1. Алгоритм дій при ГКС на першому етапі медичної допомоги
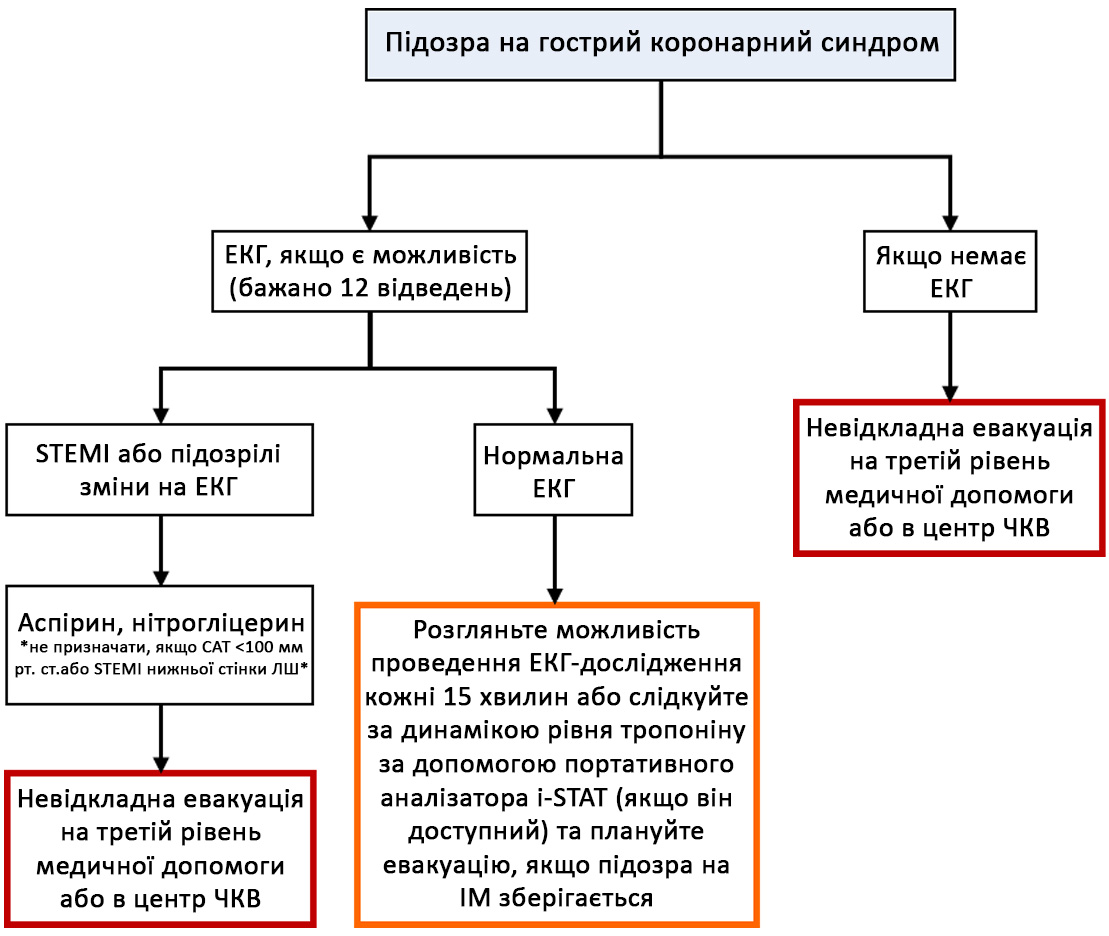
Схема C-2. Алгоритм дій при ГКС на другому етапі медичної допомоги
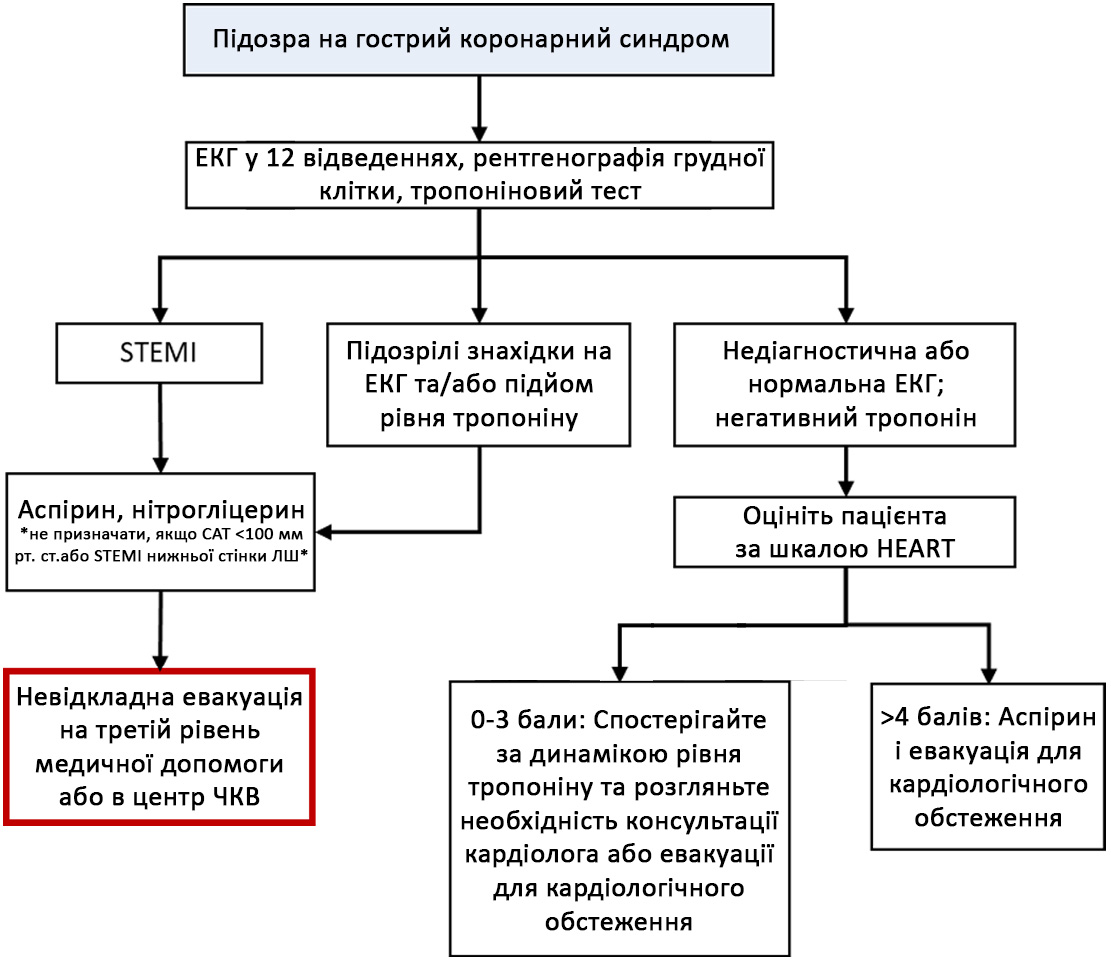
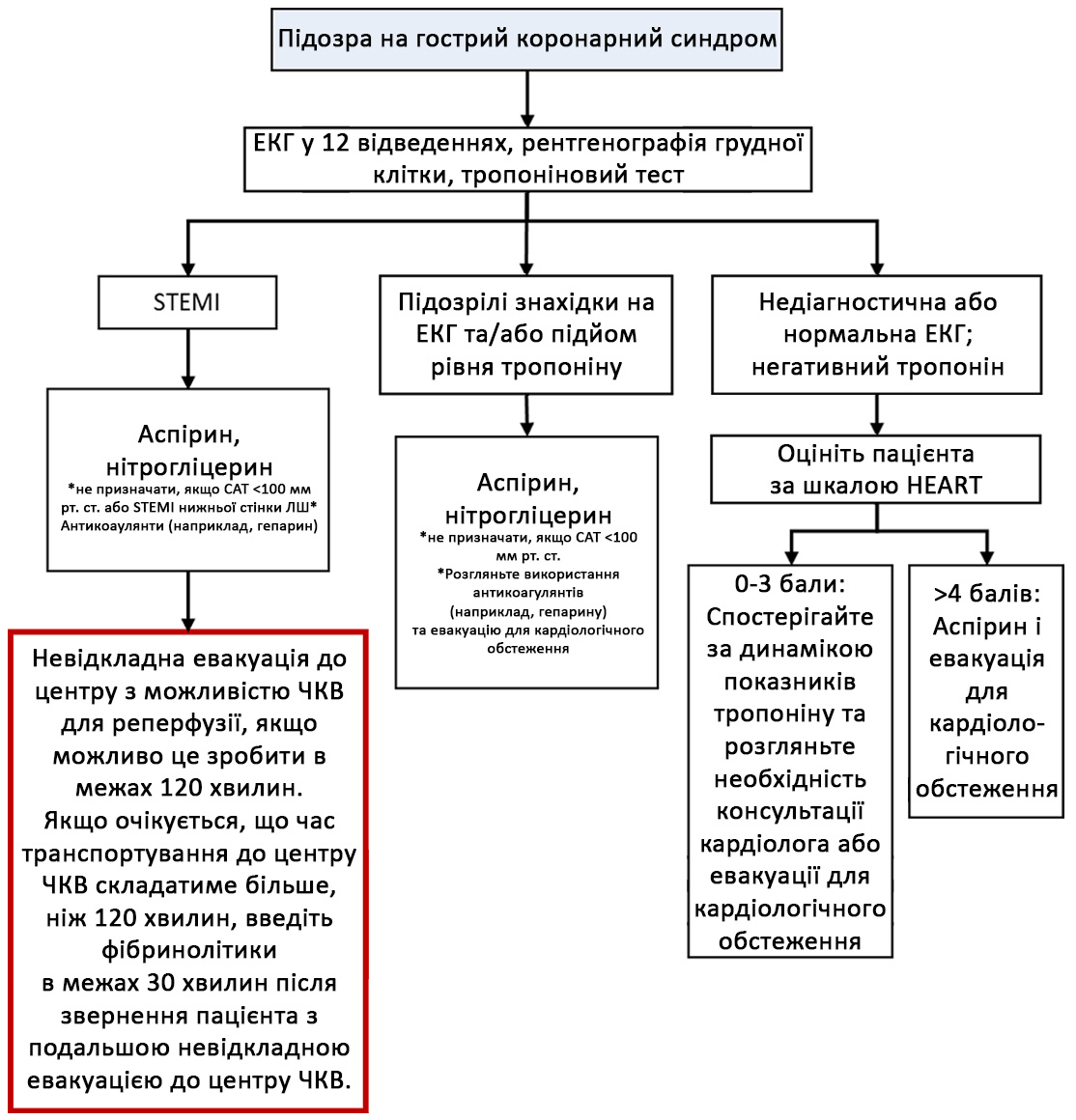
Схема C-3. Алгоритм дій при ГКС на третьому етапі медичної допомоги
Додаток D: Додаткова інформація щодо не передбаченого інструкцією застосування лікарських засобів у Настановах з клінічної практики
Мета
Мета цього Додатка — надати роз’яснення політики та практики Міністерства оборони США щодо включення в Настанови з клінічної практики «незатверджених» показів для продуктів, які були схвалені Управлінням з контролю якості продуктів харчування і лікарських засобів США (FDA). Це стосується використання препаратів не за призначенням для пацієнтів, які належать до Збройних сил США.
Вихідна інформація
Незатверджене (тобто «не за призначенням» - “off-label”) використання продуктів, схвалених FDA, надзвичайно поширене в медицині США і зазвичай не регулюється окремими нормативними актами. Проте, згідно з Федеральним законодавством, за деяких обставин застосування схвалених лікарських засобів за незатвердженими показами регулюється положеннями FDA про «досліджувані нові ліки». До цих обставин належить використання в рамках клінічних досліджень, а також, у військовому контексті, використання за незатвердженими показами згідно з вимогами командування. Деякі види використання за незатвердженими показами також можуть підлягати окремим нормативним актам.
Додаткова інформація щодо застосування за незатвердженими показами у Настановах з клінічної практики
Включення до Настанов з клінічної практики використання медикаментів за незатвердженими показами не належить до клінічних випробувань і не є вимогою командування. Більше того, таке включення не передбачає, що Військова система охорони здоров’я вимагає від медичних працівників, які працюють в структурах Міноборони США, застосовувати відповідні продукти за незатвердженими показами або вважає це «стандартом медичної допомоги». Швидше, включення до CPGs використання засобів «не за призначенням» має поглиблювати клінічне судження відповідального медичного працівника шляхом надання інформації щодо потенційних ризиків та переваг альтернативного лікування. Рішення приймається на основі клінічного судження відповідальним медичним працівником у контексті відносин між лікарем і пацієнтом.
Додаткові процедури
Виважений розгляд
Відповідно до цієї мети, в обговореннях використання медикаментів «не за призначенням» в CPG конкретно зазначено, що це використання, яке не схвалено FDA. Крім того, такі обговорення є збалансованими у представленні даних клінічних досліджень, включаючи будь-які дані, які свідчать про обережність у використанні продукту, і, зокрема, включаючи усі попередження, видані FDA.
Моніторинг забезпечення якості
Що стосується використання «не за призначенням», діяльність Міністерства оборони США полягає у підтримці регулярної системи моніторингу забезпечення якості результатів і відомих потенційних побічних ефектів. З цієї причини підкреслюється важливість ведення точних клінічних записів.
Інформація для пацієнтів
Належна клінічна практика передбачає надання відповідної інформації пацієнтам. У кожних Настановах з клінічної практики, де йдеться про використання засобу «не за призначенням», розглядається питання інформування пацієнтів. За умови практичної доцільності, слід розглянути можливість включення додатка з інформаційним листком для пацієнтів, що видаватиметься до або після застосування продукту. Інформаційний листок має в доступній для пацієнтів формі повідомляти наступне: a) що дане застосування не схвалене FDA; b) причини, чому медичний працівник Міністерства оборони США може прийняти рішення використати продукт з цією метою; c) потенційні ризики, пов’язані з таким застосуванням.







































