Вихідна інформація
Відомо, що у пацієнтів із множинними травмами розвивається ураження легенів1, яке може призвести до тривалої втрати працездатності або навіть смерті.2 Нещодавній огляд смертей унаслідок бойових дій після надходження до лікарні свідчить, що 8% смертей, яким можна було б запобігти, є результатом поліорганної недостатності, яка включає ГРДС.3 Мета цієї настанови — розглянути діагностичні критерії ГРДС, описати частоту виникнення цього розладу у поранених військовослужбовців і рекомендувати низку стратегій для безпечної аеромедичної евакуації цих пацієнтів.
Спостереження за дихальною недостатністю у поранених в умовах бойових дій ведуться вже більше століття. Певний ступінь ГРДС зустрічається у 26–33% поранених.1,4,5 Огляд Реєстру травм Міністерства оборони (DoDTR) виявив 152 пацієнти з ГРДС за 7-річний період.6 Незалежні фактори ризику для ГРДС включали жіночу стать, шок або тахікардію при поступленні та тяжке поранення (показник тяжкості бойового поранення (mISS) ≥ 25). Пацієнти з ГРДС мали значно підвищений ризик смерті порівняно з інтубованими контрольними групами (12,8% проти 5,9%, співвідношення шансів 1,99, 95% довірчий інтервал 1,12, 3,52, p=0,02). Подальший аналіз цієї популяції виявив, що посилені інфузії кристалоїдів і переливання свіжозамороженої плазми (СЗП) є незалежними прогностичними чинниками ГРДС.7
Визначення
-
ГРДС виникає внаслідок як прямого, так і непрямого ураження легень. Поширені причини ГРДС після прямого ураження включають пневмонію або аспірацію вмісту шлунка. У поранених внаслідок бойових дій до ГРДС можуть призвести такі прямі ураження, як контузія легень, інгаляційні травми та жирова емболія. ГРДС внаслідок непрямого ураження легень може виникнути у пацієнтів, які отримують багаторазові переливання крові, у яких розвивається септичний шок або у пацієнтів із тяжким гострим панкреатитом.
- При діагностуванні ГРДС слід виключити серцеву недостатність або перевантаження рідиною. Кілька інших патологічних процесів також можуть імітувати ГРДС. Пацієнтам з такими розладами принесе користь захисна вентиляція легень, але також можуть знадобитися втручання, спрямовані безпосередньо на патологічний процес. Приклади включають гостру еозинофільну пневмонію (ГЕП), гостру інтерстиціальну пневмонію (ГІП), облітеруючий бронхіоліт з організуючою пневмонією (ОБОП) і дифузну альвеолярну кровотечу (ДАК).8
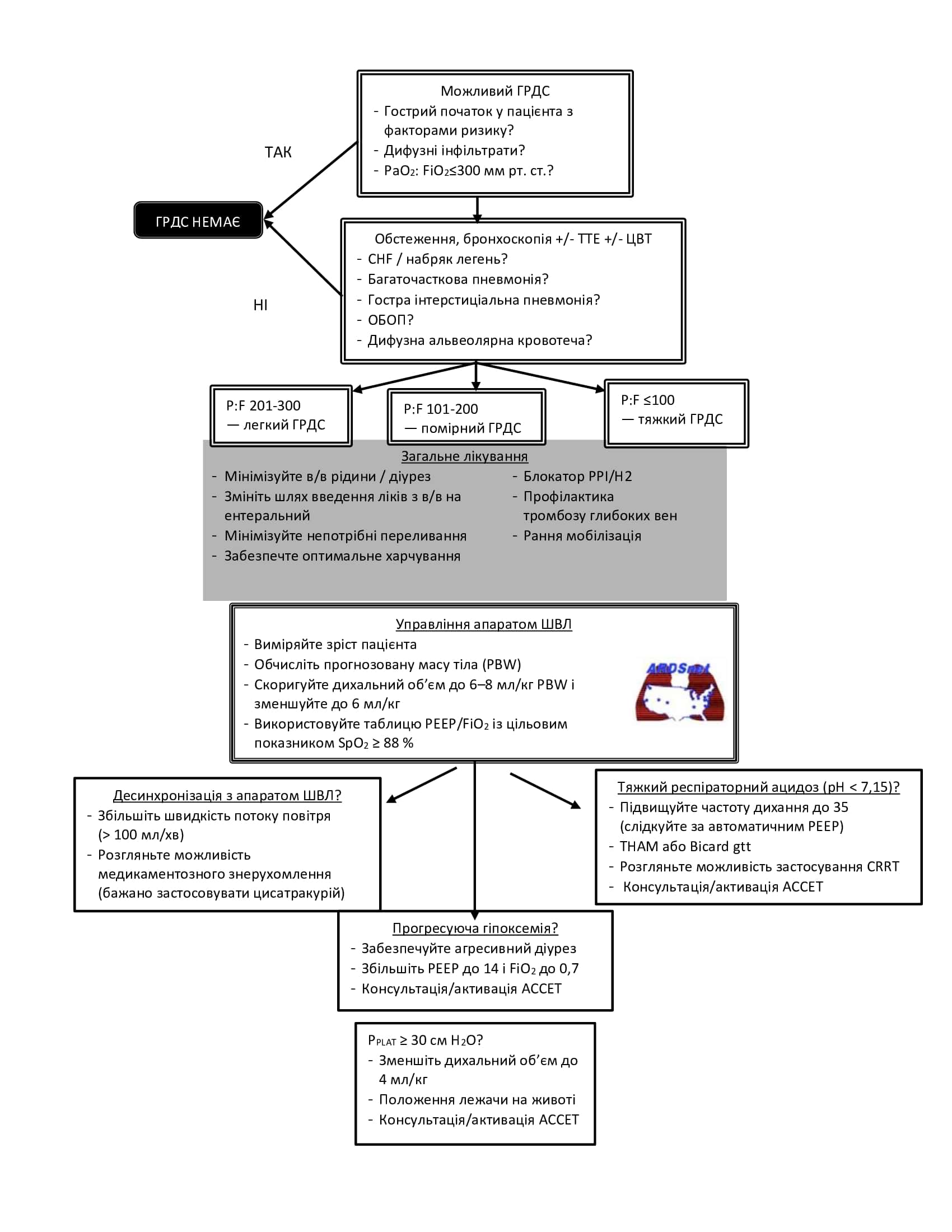
- Визначення ГРДС було оновлено в 2012 р. Нове берлінське визначення ГРДС відображає діапазон тяжкості від легкого до помірного та тяжкого, визначає «гострий початок» у межах одного тижня та вказує на потребу в позитивному кінцевому тиску видиху (PEEP) ≥ 5 см H2O.9 Оригінальне визначення ГРДС, надане Американсько-європейською консенсусною конференцією (AECC), яке також включало гостру легеневу травму (ALI)10, є менш практичним; тому ці настанови CPG посилатимуться на нове берлінське визначення. ГРДС має розвинутися не пізніше тижня після підтвердженого клінічного ураження, описаного вище, або виникнути в контексті появи нових або погіршення наявних респіраторних симптомів. На зображеннях грудної клітки (рентген або КТ) мають бути двосторонні затемнені ділянки, які неможливо повністю пояснити набряком легень, випотом/гемотораксом, лобарним колапсом або легеневими вузликами. Якщо зазначені вище критерії дотримані, ступінь гіпоксемії з PEEP або постійним позитивним тиском у дихальних шляхах (CPAP), який становить щонайменше 5 см H2O, визначає ступінь тяжкості ГРДС.
- Легкий ГРДС = співвідношення PaO2 до FiO2 (P:F) між > 200 та ≤ 300.
- Помірний ГРДС = P:F між >100 та ≤ 200.
- Тяжкий ГРДС = P:F ≤ 100.
- Діагноз ГРДС зазвичай ставлять пацієнтам із дихальною недостатністю, яка вимагає інтубації та ШВЛ.
Діагностика
Для пацієнтів, у яких на основі результатів рентгенографії та налаштувань апарата ШВЛ підозрюють ГРДС, слід підтвердити діагноз, дотримуючись наведених нижче вказівок.
- Переконайтесь, що у пацієнта є імовірність виникнення дихальної недостатності внаслідок прямого чи непрямого ушкодження легень або потреби в штучній вентиляції легень.
- Розгляньте діагнози, що можуть імітувати ГРДС, як описано вище.
- Виконайте високоякісну рентгенограму у передньо-задній вертикальній проекції та знайдіть дифузні інфільтрати. Розгляньте можливість виконання КТ, якщо цей метод візуалізації доступний, а стан пацієнта є достатньо стабільним для транспортування у відділення КТ.
- Якщо кардіогенний набряк легень та (або) перевантаження рідиною не можна повністю виключити як причину або фактор, що сприяє дихальній недостатності пацієнта, розгляньте можливість встановлення катетера для вимірювання центрального венозного тиску та, якщо можливо, зробіть трансторакальну ехокардіограму.11,12
- Переведіть пацієнта на вентиляцію з керованим об’ємом або тиском.
- Дихальний об’єм (VT) має становити приблизно 6–8 мл/кг на основі прогнозованої маси тіла (Predicted Body Weight, PBW) (як зазначено в картці ARDSNet у Додатку B) із цільовим тиском плато (PPLAT) ≤ 30 см H2O. При використанні режиму вентиляції з керованим тиском налаштуйте тиск на вдиху на 30–35 см H2O, після чого поступово зменшуйте його, щоб досягти VT на рівні 6–8 мл/кг.
- Встановіть частоту дихальних рухів між 6 і 35 та скоригуйте її для досягнення pH ≥ 7,3.
- Налаштуйте PEEP (мінімум 5 см H2O) та FiO2 згідно з таблицею ARDSNet23, щоб досягти SpO2 на рівні 88–95 % (PaO2 55–80 мм рт. ст.). Дайте газообміну пацієнта врівноважитись протягом 30 хвилин, а потім виконайте аналіз газів крові ABG, щоб обчислити співвідношення P:F пацієнта.
Якщо ГРДС підтверджено, задокументуйте ступінь тяжкості (легкий, помірний, тяжкий) у карті пацієнта із зазначенням використаних діагностичних критеріїв. У нещодавньому дослідженні також було продемонстровано, що індекс оксигенації з поправкою на вік (AOI) точно передбачає прогноз у пацієнтів із ГРДС.13 Традиційно індекс оксигенації (OI) розраховується на основі MAP (середнього тиску в дихальних шляхах). Вказане дослідження використовувало базу даних ARDSNet, в якій реєструється PPLAT замість MAP, тому AOI обчислювався за формулою (100xPPLAT)/(P:F)+вік. Автори дослідження виявили, що AOI на рівні 80–99 протягом перших чотирьох днів ГРДС пов’язане з 50% смертністю.
Пацієнти дитячого віку з травмами також належать до групи ризику виникнення ГРДС.14 Незважаючи на чимало подібностей у патофізіології ГРДС у дорослих і дітей, нещодавні наукові дані підтверджують дещо інший підхід до діагностичних критеріїв, що використовуються при педіатричному ГРДС.15,16 Подібно до берлінських критеріїв для дорослих, ГРДС у дітей передбачає наявність дихальної недостатності, яка не пояснюється серцевою недостатністю або перевантаженням рідиною. Проте замість використання співвідношення P:F нещодавно було рекомендовано використання індексу оксигенації (OI) для визначення ступеня тяжкості ГРДС у пацієнтів дитячого віку. Як вже зазначалося вище, OI можна обчислити як (100xMAP)/(P:F). Легкий ГРДС можна визначити, якщо індекс OI перебуває в діапазоні від 4 до <8, середній ГРДС визначається як OI від 8 до <16, тоді як тяжкий ГРДС спостерігається при OI ≥ 16.15,16
Лікування
При лікуванні пацієнтів із ГРДС слід підтримувати газообмін безпечним чином без подальшого пошкодження легень пацієнта.17 Доведено, що використання стратегії захисту легень у всіх інтубованих пацієнтів покращує клінічні результати.18–20 Медичні працівники також повинні усвідомлювати, що при використанні апаратів ШВЛ в евакуаційних транспортних засобах існують деякі обмеження, і що під час аеромедичної евакуації PaO2 пацієнта завжди знижуватиметься21,22
У пацієнтів із ГРДС метою є обмеження баротравми (PPLAT ≤30 см H2O або максимальний тиск на вдиху, PIP≤35 см H2O, якщо PPLAT неможливо виміряти), волюмотравми (VT 6-8 мл/кг PBW) та ателектравми (від помірного до високого PEEP).17 Слід намагатися забезпечити цільові показники SpO2 ≥ 88–95% і рН≥7,3 (при черепно-мозковій травмі цей цільовий рН має досягатися при PaCO2, що підтримується на рівні 35-40 мм рт.ст.).
При лікуванні всіх пацієнтів із середнім і тяжким ГРДС слід на ранніх етапах звертатися по консультацію до реаніматолога. Індивідуальну консультацію військового лікаря можна отримати, звернувшись до регіонального медичного центру в Ландштулі (LRMC) за номером DSN 314-486-7141 або до військово-медичного центру Сан-Антоніо (SAMMC) за номером DSN 312-429-BURN (2876).
Лікування пацієнтів у закладі III рівня представлене в Додатку A.
Штучна вентиляція легень і газообмін
Налаштування апарата ШВЛ для захисту легень
Після встановлення діагнозу ГРДС пацієнта слід перевести на вентиляцію, що забезпечує захист легень із налаштуваннями апарата ШВЛ відповідно до правил ARDSNet.23 Показник PBW (прогнозованої маси тіла) пацієнта визначається шляхом вимірювання зросту пацієнта, а потім за допомогою відповідних розрахунків на основі статі. Зверніть увагу, що є дві різні таблиці PEEP — одна із нижчим PEEP і вищим FiO2, і друга з вищим PEEP і нижчим FiO2. Допускається використовувати будь-яку з таблиць, проте результати метааналізу свідчать про тенденцію покращення виживаності при використанні таблиці з високим PEEP у пацієнтів із ГРДС від середнього до тяжкого ступеня згідно із сучасними критеріями.24 У всіх випадках мінімальний тиск на вдиху (PPLAT – PEEP) має бути якнайнижчим, щоб оптимізувати шанси пацієнта на виживання.25 На початку лікування можна використовувати VT, що становить 8 мл/кг, проте цей показник слід зменшити до 6 мл/кг протягом 2–4 годин. Якщо PPLAT залишається вищим за 30 см H2O, дихальний об’єм можна ще скоротити до 4 мл/кг, якщо є свідчення належного постачання кисню до периферичних тканин (нормальний рівень лактату і лужного дефіциту).26 На додаток до вентиляції з керованим об’ємом можна використовувати інші режими, проте на розсуд реаніматолога, який має досвід у лікуванні ГРДС.
Екстрена оксигенотерапія
У середовище з обмеженим забезпеченням сучасні методи лікування ГРДС не завжди доступні. Маневри відкриття (рекрутменту) легень низького рівня шляхом утримання тиску 40 см H2O протягом 40 секунд можуть виконуватися лікарем, проте бригада повинна бути готовою до роботи з нестабільної гемодинамікою з огляду на зменшене венозне повернення. Інші заходи, такі як інгаляційний оксид азоту (iNO) або інгаляційний простациклін (Flolan) зазвичай недоступні в закладах III рівня. Удосконалені режими штучної вентиляції легень, такі як вентиляція зі зворотним співвідношенням вдиху до видиху або вентиляція зі скиданням тиску в дихальних шляхах (APRV), слід використовувати під наглядом досвідченого реаніматолога.
Екстракорпоральне життєзабезпечення
Раннє вено-венозне екстракорпоральне життєзабезпечення (Veno-Venous Extracorporeal Life Support, vvECLS) надзвичайно важливе для пацієнтів, у яких спроби вентиляції із захистом легень не приносять успіху.27 Якщо цілі газообміну та перфузії не досягаються після 12 годин вентиляції із захистом легень, а пацієнт знерухомлений і перебуває в положенні лежачи на животі, слід розглянути екстракорпоральну підтримку. Крім того, транспортування пацієнтів, які перебувають на підтримці vvECLS, може бути безпечнішим і легшим, якщо є бригада, що може забезпечити перевезення з екстракорпоральною підтримкою. (Див. розділ «Транспортування пацієнтів з ГРДС» нижче).
Показання для початку екстракорпоральної мембранної оксигенації (ЕКМО) при дихальній недостатності включають:
- Співвідношення P:F <100 або тиск плато >30 см H2O незважаючи на оптимальне застосування апарата ШВЛ.
- Респіраторний ацидоз із показниками pCO2> 70 та pH < 7,25 незважаючи на оптимальне застосування апарата ШВЛ.
- Початок екстрених процедур для лікування ГРДС (PEEP > 15, положення лежачи на животі, високочастотна осциляція (High Frequency Oscillation, HFOC), iNO, тривале знерухомлення)
- Дихальна недостатність, пов’язана зі значною баротравмою, вимагає вентиляційної підтримки.
Консультація щодо ЕКМО доступна цілодобово. Координацію здійснює опікове відділення Інституту хірургічних досліджень (ISR) (210-222-BURN). Через потенційні катастрофічні наслідки гострої дихальної недостатності та час, необхідний для формування транспортної бригади ЕКМО, раннє сповіщення набуває першочергового значення. Надзвичайно важливо на ранніх етапах провести консультацію з бригадою ЕКМО, навіть якщо це відбувається раніше 12 годин від моменту дихальної недостатності.
Нейром’язова блокада
Якщо у пацієнта тяжкий ГРДС або він швидко погіршується, короткий курс (48 годин) нервово-м’язової блокади може сприяти подальшому використанню вентиляції із захистом легень (LPV), одночасно усуваючи такі проблеми, як десинхронізація з апаратом ШВЛ.28 Ця стратегія сприяє виживанню пацієнтів із підтвердженим ГРДС при застосуванні на ранніх стадіях патологічного стану (не пізніше 48 годин). Порівняно з іншими нейром’язовими блокаторами, цисатракурій (Nimbex®) мінімізує ризик нейропатії або мієлопатії, пов’язаної з інтенсивною терапією, та не потребує корекції дози при нирковій або печінковій недостатності. Таким чином, цисатракурій є оптимальним нейром’язовим блокатором для пацієнтів з ГРДС.29, 30
Положення лежачи на животі
Якщо у пацієнта уражені переважно нижні частки легень (на основі результатів рентгенографії або комп’ютерної томографії), слід спробувати розташувати пацієнта в положення лежачи на животі на 2–6 годин.31 Якщо газообмін пацієнта покращується, продовжуйте лікування пацієнта в положенні долілиць. Нещодавнє дослідження пацієнтів із помірним та тяжким ГРДС (P:F <150) продемонструвало зменшення рівня смертності при застосуванні положення лежачи на животі протягом 16 годин на день.32 Бажано, щоб цей маневр виконувала досвідчена бригада, щоб уникнути зміщення трубки/лінії під час переведення пацієнта в положення долілиць; у фронтових умовах або середовищі з обмеженими ресурсами виконання цього маневру може бути непрактичним. Електроди ЕКГ слід розташувати на спині пацієнта, а повіки заклеїти пластиром для захисту очей. Цей підхід найкраще реалізовувати у рамках протоколу переведення в положення лежачи на животі, який включає показання та протипоказання, контрольний список перед зміною положення та опис сестринського догляду за пацієнтом, який перебуває в положенні долілиць.
Робота з інфузійними розчинами
У пацієнтів з ГРДС із позитивним балансом рідини спостерігається підвищена смертність.33 Таким чином, заохочується раннє та агресивне обмеження зайвого інфузійного об’єму шляхом усунення будь-яких «підтримувальних внутрішньовенних розчинів», максимальної концентрації всіх засобів, які слід вводити крапельним шляхом, та зміни шляху введення препаратів із внутрішньовенного на ентеральний. Якщо гемодинаміка пацієнта допускає діурез, його слід активно стимулювати.34 В умовах гемодинамічного компромісу слід намагатися мінімізувати об’єм і бути розважливим при будь-яких пробах діурезу. Деякі заклади III рівня мають обладнання для постійної замісної ниркової терапії (CRRT), яку також можна застосовувати для усунення надлишкового внутрішньосудинного об’єму в умовах порушення функції нирок під керівництвом реаніматолога або нефролога, які володіють досвідом застосування цієї терапії (Див. настанови CPG JTS Hyperkalemia and Dialysis in the Deployed Setting 35). Якщо у пацієнта спостерігається гіпопротеїнемія (тобто загальний білок <6 г/дл), застосування альбуміну 25 г в/в кожні 8 годин (100 мл 25% альбуміну) у поєднанні з діурезом протягом 3–5 днів продемонструвало покращення оксигенації та діурезу в рамках двох проспективних рандомізованих досліджень у пацієнтів із ГРДС. Мета терапії полягає у забезпеченні ЦВТ на рівні <4 мм рт. ст. із підтвердженням ефективного кровообігу на основі обстеження (тепла шкіра, відсутність плям на шкірі та наповнення капілярів <2 с), а також адекватного сечовиділення (≥ 0,5 мл/кг/год).12
Переливання продуктів крові
Продукти крові несуть ризик провокування або загострення дихальної недостатності.36–39 У нещодавньому дослідженні DoDTR було показано, що помірна кількість переливань еритроцитів (2–14) підвищувала ризик ГРДС. Крім того, кожна одиниця додаткової перелитої плазми підвищувала ризик розвитку ГРДС у інтубованих пацієнтів з бойовими пораненнями на 7%.36 Подібні результати також були продемонстровані у цивільних пацієнтів.39 Таким чином, надзвичайно важливо збалансувати переваги реанімаційних заходів з контролем пошкоджень із ризиком розвитку ГРДС. Якщо у пацієнта спостерігається кровотеча, що вимагає відновлення об’єму крові, від продуктів крові відмовлятися не слід. Крім того, пацієнтам із тяжким ГРДС, рефрактерним до максимальної вентиляційної підтримки, може знадобитися переливання додаткових еритроцитів для підтримки належного постачання кисню. З іншого боку, пацієнт із безсимптомною анемією40, у якого припинилася кровотеча, або із помірним підвищенням міжнародного нормалізованого відношення (МНВ) та нормальною тромбоеластограмою або ротаційною тромбоеластограмою, найімовірніше, не потребує переливання додаткових продуктів крові.
Застосування кортикостероїдів
Застосування внутрішньовенних стероїдів загалом не показало жодної користі на початковому етапі лікування ГРДС.41 Однак застосування кортикостероїдів у низьких і середніх дозах у надзвичайно обмеженій популяції пацієнтів може покращити легеневу механіку та скоротити кількість днів на апараті ШВЛ та у відділенні інтенсивної терапії без підвищення кількості ускладнень, у тому числі інфекцій та нейропатії/мієлопатії.42,43 До цієї обмеженої популяції переважно належать пацієнти із «пізнім» або «пролонгованим» ГРДС, що визначається як ГРДС тривалістю ≥7 днів. Дослідження ARDSNet Late Steroid Rescue Study Trial продемонструвало потенційну користь стероїдів у підгрупі пацієнтів із ГРДС тривалістю 7–13 днів та потенційну шкоду стероїдів при застосуванні у пацієнтів із ГРДС тривалістю ≥14 днів. Для пацієнтів без протипоказань рекомендована схема метилпреднізолону становить 2 мг/кг в/в одноразово з подальшою інфузією 2 мг/кг/добу (можна розділити на введення кожні 6 годин) протягом 14 днів (або протягом інтубації, залежно від того, що триває коротше). На основі клінічного судження можна зменшувати дозу інфузії протягом 7–21 дня. Якщо застосування стероїдів не було розпочато протягом двох тижнів після діагностування ГРДС, їх слід уникати через підвищену смертність внаслідок затримки терапії.44 Варто відзначити, що гостра еозинофільна пневмонія (ГЕП) може імітувати ГРДС — відповідні випадки були описані у військовослужбовців, які нещодавно почали курити.45 ГЕП є високочутливою до стероїдної терапії, тому надзвичайно важливо правильно диференціювати ГЕП від більш поширеного ГРДС.
Харчування і профілактика венозної тромбоемболії
Пацієнти з ГРДС отримують належне підтримувальне харчування (Див. настанови CPG Nutritional Support Using Enteral and Parenteral Methods).46 Якщо функцію системи травлення не порушено, краще використовувати ентеральне харчування. З цією метою слід розглянути можливість встановлення назоеюнального зонду; якщо зонд для годування неможливо просунути через пілорус, також можна використати назогастральний зонд. Профілактику стресової виразки рекомендується виконувати у важкохворих інтубованих пацієнтів, а для всіх пацієнтів із ГРДС слід розглянути можливість медикаментозної профілактики венозної тромбоемболії (ВТЕ) після досягнення адекватного гемостазу.
Седація і фізіотерапія
Основним довгостроковим ускладненням ГРДС є неврологічні порушення та розлади опорно-рухового апарату внаслідок тривалого знерухомлення.29,30 З огляду на це слід якнайраніше здійснювати щоденні спроби виведення пацієнтів зі сну («пауза в седації»)47 та розпочинати активну програму ранньої мобілізації. Вона полягає в поетапному підході, що розпочинається вже під час інтубації, починаючи з пасивного діапазону рухів (виконуються кілька разів на день медпрацівниками, медсестрами, фізіотерапевтами, колегами або членами сім’ї), з переходом до сидіння на краю ліжка, пересування від ліжка до стільця та пересування зі сторонньою допомогою.48, 49
ГРДС у дітей
Застосування апарата ШВЛ для лікування ГРДС у дітей аналогічне до штучної вентиляції у дорослих: мета полягає в обмеженні уражень легень, викликаних застосуванням апарата ШВЛ. Крім того, додаткові та реанімаційні заходи при лікуванні ГРДС у дітей аналогічні заходам, що застосовуються у дорослих.16
Транспортування пацієнтів з ГРДС
Можливості аеромедичної евакуації
Бригада з аеромедичної евакуації (CCATT) регулярно здійснює вивезення інтубованих американських військовослужбовців із зони бойових дій.50–52 З жовтня 2001 р. до травня 2006 р. такі пацієнти становили 1265 з 1995 (63%) усіх пацієнтів, евакуйованих командою CCATT.53 Рішення про транспортування пацієнта з ГРДС має прийматися спільно з керівником CCATT для зони бойових дій, головним льотним хірургом, місцевим лікарем CCATT і завідувачем травматологічного відділення або відділення інтенсивної терапії в закладі III рівня. Слід враховувати ступінь тяжкості дихальної недостатності пацієнта, динаміку дихальної недостатності (полегшення чи погіршення) та досвід евакуаційної бригади.22
Бригади з аеромедичної евакуації ВПС США використовують як апарат ШВЛ Impact 731™ (Zoll Medical Corporation., Челмфорд, Массачусетс), так і LTV 1000™ (CareFusion, Йорба-Лінда, Каліфорнія).54 Апарат Impact 731 пропонує режими керованого об’єму, керованого тиску, SIMV і CPAP з підтримкою тиску і без неї. Допускається застосовувати до 100% O2, а також PEEP до 25 см H2O. Швидкість потоку коливається від 0 до 100 л/хв при 40 см H2O. Максимальний тиск на вдиху коливається від 10 до 80 см H2O. Апарат Impact 731 не підтримує режим вентиляції зі зворотним співвідношенням вдиху до видиху.
Можливості розширеної аеромедичної евакуації
У 2012 р. військово-медичний центр Сан-Антоніо (SAMMC) створив бригаду, що спеціалізується на екстракорпоральному життєзабезпеченні (ECLS), що дає можливість тривалого транспортування пацієнтів із тяжким ГРДС із наданням екстракорпорального життєзабезпечення або без нього. До складу бригади входить лікар-реаніматолог, який спеціалізується на легеневих захворюваннях, хірург-реаніматолог, реанімаційна медсестра та фахівець із респіраторної терапії. Передові методи лікування, що використовуються цією бригадою, включають високочастотний апарат ШВЛ (Percussionaire VDR-4), інгаляційний простациклін (Flolan) і екстракорпоральне життєзабезпечення для підтримки пацієнтів із помірним та тяжким ГРДС, яких інакше неможливо безпечно транспортувати.55–58
До показань для транспортування пацієнтів у США із залученням бригади розширеної аеромедичної евакуації належать:
- PaO2: FiO2 < 100.
- Інгаляційна травма.
- FiO2 > 0,7 або pH < 7,25 при застосуванні вентиляції із захистом легень.
- PEEP > 15 см H2O із PPLAT > 30 см H2O.
- Тяжка черепно-мозкова травма із PaCO2 > мм рт. ст. при використанні портативного апарата ШВЛ.
- Кардіогенний шок, рефрактерний до максимальної медикаментозної терапії.
- Анатомічні порушення (наприклад, бронхоплевральна фістула, пневмонектомія).
- Використання складних режимів ШВЛ, таких як APRV.
- Гостра тромбоемболія легеневої артерії (ТЕЛА) із зупинкою серця або постійною гіпоксемією.
- Поліорганна недостатність (наприклад ГРДС + ниркова недостатність).
Члени бригади розширеної аеромедичної евакуації (ACCET) пройшли спеціальну підготовку щодо показань і використання цих методів, які були належним чином перевірені фахівцями з надання допомоги пораненим в умовах бойових дій та евакуаційними бригадами.
- Високочастотна вентиляція може бути корисною у випадках гнійної пневмонії або інгаляційної травми завдяки стимуляції виділень із одночасним безпечним газообміном.59
- Екстракорпоральне життєзабезпечення застосовується для лікування дихальної недостатності у дорослих із хорошими результатами, як продемонстровано в нещодавніх серійних дослідженнях із використанням сучасного обладнання.60-62 Більшість заходів екстракорпорального життєзабезпечення для дорослих є вено-венозними, які можна виконати або шляхом канюляції внутрішньої яремної вени в одному місці, або через комбіновану канюляцію внутрішньої яремної і стегнової вени чи подвійну канюляцію стегнової вени. Системне застосування гепарину слід розпочинати після зупинки хірургічної кровотечі. Цей підхід безпечно використовувався у пацієнтів із травмами як у США, так і в Німеччині, включаючи пацієнтів із черепно-мозковою травмою (ЧМТ).62–65
- Розширену аеромедичну евакуацію (ACCET) має ініціювати завідувач травматологічного відділення або відділення інтенсивної терапії базового закладу, звернувшись до транспортного командування США (TRANSCOM) за допомогою стандартної процедури між театрами бойових дій. Це сприятиме своєчасному залученню відповідної бригади. Індивідуальну консультацію лікаря можна отримати, звернувшись до регіонального медичного центру LRMC за номером DSN 314-486-7141 або до медичного центру SAMMC за номером DSN 312-429-BURN (2876). Заохочується якнайраніше звертатись по консультацію та залучати бригаду, що спеціалізується в екстракорпоральному життєзабезпеченні.
- З листопада 2005 р. по березень 2007 р. бригади аеромедичної евакуації CCATT виконали транспортування 524 інтубованих пацієнтів. П’ять із них були перевезені розширеною реанімаційною бригадою медичного центру LRMC, до якої зверталися загалом 11 разів. Із п’яти пацієнтів, які потребували залучення розширеної реанімаційної бригади, четверо вижили до виписки з лікарні.66 Крім того, з 10 поранених військовослужбовців США, евакуація яких відбувалась із застосуванням безнасосної екстракорпоральної підтримки функції легень (Pumpless Extracorporeal Lung Assist, PECLA) або заходів екстракорпорального життєзабезпечення, дев’ять дожили до виписки з лікарні.55 Ці дані підкреслюють важливість використання наявних ресурсів для транспортування таких уразливих пацієнтів до закладу надання основної допомоги.
Результати
Серед цивільного населення внутрішньолікарняна смертність пацієнтів із ГРДС залишається на рівні понад 40%67, а 5-річна смертність становить приблизно 60%.68 Для пацієнтів із травмами ГРДС сприяє розвитку ускладнень69 і також може підвищувати смертність,70 хоча у сучасних наукових публікаціях з цивільної медицини спостерігається певна непослідовність71. Водночас, як зазначено вище, ГРДС є незалежним фактором ризику смерті у поранених внаслідок бойових дій. Щоб зменшити цей ризик, слід на ранніх етапах розпочинати штучну вентиляцію із захистом легень разом із мінімізацією зайвих внутрішньовенних інфузій, усуненням непотрібних переливань препаратів крові та, якщо це можливо, впровадженням режиму агресивної фізіотерапії. Також слід розглянути можливість раннього залучення системи евакуації ACCET.
Моніторинг покращення показників (ПП)
Цільова популяція
Усі пацієнти на штучній вентиляції легень.
Мета (Очікувані результати)
- Пацієнти з гострим респіраторним дистрес-синдромом (ГРДС) отримують штучну вентиляцію із захистом легень.
- Консультація з бригадою розширеної медичної евакуації відбувається упродовж 4 годин, якщо виконуються відповідні критерії (наприклад, PaO2:FiO2 < 100, FiO2> 70 %, PEEP > 15 см H2O при Pplat > 30 см H2O, тяжка ЧМТ із PaCO2 > 40 мм рт. ст. тощо).
Кількісні показники результативності/Дотримання рекомендацій
- Кількість і відсоток пацієнтів з діагностованим ГРДС, які отримують початковий дихальний об’єм на рівні 6–8 мл/кг.
- Кількість і відсоток пацієнтів, щодо яких було проведено консультацію з бригадою розширеної медичної евакуації упродовж 4 годин, якщо виконуються відповідні критерії (наприклад, PaO2:FiO2 < 100, FiO2> 70 %, PEEP > 15 см H2O при Pplat > 30 см H2O, тяжка ЧМТ із PaCO2 > 40 мм рт. ст. тощо) і пацієнт відповідає вимогам для евакуації (поранений військовослужбовець США або однієї з країн коаліції).
Джерело даних
- Карта пацієнта.
- Реєстр травм Міністерства оборони (Department of Defense Trauma Registry, DoDTR).
Системна звітність і частота звітування
Згідно з цими Настановами, вказане вище становить мінімальні критерії моніторингу ПП. Системна звітність виконуватиметься щороку; додатковий моніторинг ПП та заходи із системної звітності можна виконувати залежно від потреб.
Системний перегляд та аналіз даних виконуватиме керівник JTS та Відділ ПП JTS.
Обов’язки
Керівник травматологічної бригади відповідає за ознайомлення з цими Настановами, належне дотримання вказаних у ньому вимог та моніторинг ПП на місцевому рівні.
-
- Edens JW, Chung KK, Pamplin JC, et al. Predictors of early acute lung injury at a combat support hospital: a prospective observational study. J Trauma 2010;69 Suppl 1:S81–6.
- Rubenfeld GD, Caldwell E, Peabody E, et al. Incidence and outcomes of acute lung injury. N Engl J Med 2005;353(16):1685–93.
- Eastridge BJ, Hardin M, Cantrell J, et al. Died of wounds on the battlefield: causation and implications for improving combat casualty care. J Trauma 2011;71(1 Suppl):S4–8.
- Patrick Allan, Brian B. Bloom, Yolanda Barnes, et al. Combat-Associated Acute Lung Injury [Internet]. In: D16. Epidemiology of Acute Lung Injury. American Thoracic Society; 2011 [cited 2015 Jun 23]. p. A5594–A5594.Available from: http://dx.doi.org/10.1164/ajrccm-conference.2011.183.1_MeetingAbstracts.A5594
- Belenkiy SM, Buel AR, Cannon JW, et al. Acute respiratory distress syndrome in wartime military burns: application of the Berlin criteria. J Trauma Acute Care Surg 2014;76(3):821–7.
- Park PK, Cannon JW, Wen Y, et al. Incidence and mortality of ARDS in combat casualty care. Poster presentation, Am. Assoc. Surg. Trauma. Pittsburgh, PA. 2009.
- Park PK, Cannon JW, Ye W, et al. Transfusion strategies and development of acute respiratory distress syndrome in combat casualty care. J Trauma Acute Care Surg 2013;75(2 Suppl 2):S238–46.
- Schwarz MI, Albert RK. “Imitators” of the ARDS: implications for diagnosis and treatment. Chest 2004;125(4):1530–5.
- Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin definition. JAMA 2012;307(23):2526–33.
- Bernard GR, Artigas A, Brigham KL, et al. The American-European Consensus Conference on ARDS. Definitions, mechanisms, relevant outcomes, and clinical trial coordination. Am J Respir Crit Care Med 1994;149(3 Pt 1):818–24.
- Duane PG, Colice GL. Impact of noninvasive studies to distinguish volume overload from ARDS in acutely ill patients with pulmonary edema: analysis of the medical literature from 1966 to 1998. Chest 2000;118(6):1709–17.
- National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network, Wheeler AP, Bernard GR, et al. Pulmonary-artery versus central venous catheter to guide treatment of acute lung injury. N Engl J Med 2006;354(21):2213–24.
- Dechert RE, Park PK, Bartlett RH. Evaluation of the oxygenation index in adult respiratory failure. J Trauma Acute Care Surg 2014;76(2):469–73.
- Davis SL, Furman DP, Costarino AT. Adult respiratory distress syndrome in children: associated disease, clinical course, and predictors of death. J Pediatr 1993;123(1):35–45.
- Khemani RG, Smith LS, Zimmerman JJ, Erickson S, Pediatric Acute Lung Injury Consensus Conference Group. Pediatric acute respiratory distress syndrome: definition, incidence, and epidemiology: proceedings from the pediatric acute lung injury consensus conference. Pediatr Crit Care Med J Soc Crit Care Med World Fed Pediatr Intensive Crit Care Soc 2015;16(5 Suppl 1):S23–40.
- Pediatric Acute Lung Injury Consensus Conference Group. Pediatric acute respiratory distress syndrome: consensus recommendations from the pediatric acute lung injury consensus conference. Pediatr Crit Care Med J Soc Crit Care Med World Fed Pediatr Intensive Crit Care Soc 2015;16(5):428–39.
- Slutsky AS, Ranieri VM. Ventilator-induced lung injury. N Engl J Med 2013;369(22):2126–36.
- Serpa Neto A, Cardoso SO, Manetta JA, et al. Association between use of lung-protective ventilation with lower tidal volumes and clinical outcomes among patients without acute respiratory distress syndrome: a meta-analysis. JAMA 2012;308(16):1651–9.
- Futier E, Constantin J-M, Paugam-Burtz C, et al. A trial of intraoperative low-tidal-volume ventilation in abdominal surgery. N Engl J Med 2013;369(16):428–37.
- Petrucci N, De Feo C. Lung protective ventilation strategy for the acute respiratory distress syndrome. Cochrane Database Syst Rev 2013;2:CD003844.
- Muhm JM, Rock PB, McMullin DL, et al. Effect of aircraft-cabin altitude on passenger discomfort. N Engl J Med 2007;357(1):18–27.
- Mason P. CCATT Mechanical Ventilation Clinical Practice Guideline. 22 Oct 2013. https://jts.health.mil/index.cfm/PI_CPGs/cpgs Accessed Mar 2018
- NHLBI ARDS Network. Ventilator Protocol Card [Internet]. [cited 2011 May 2];(May 2, 2011). Available from: http://www.ardsnet.org/node/77791.
- Briel M, Meade M, Mercat A, et al. Higher vs lower positive end-expiratory pressure in patients with acute lung injury and acute respiratory distress syndrome: Systematic review and meta-analysis. JAMA 2010;303(9):865–73.
- Amato MBP, Meade MO, Slutsky AS, et al. Driving Pressure and Survival in the Acute Respiratory Distress Syndrome. N Engl J Med 2015;372(8):747–55.
- Diaz J V, Brower R, Calfee CS, Matthay MA. Therapeutic strategies for severe acute lung injury. Crit Care Med 2010;38(8):1644–50.
- Brodie D, Bacchetta M. Extracorporeal membrane oxygenation for ARDS in adults. N Engl J Med 2011;365(20):1905–14.
- Papazian L, Forel JM, Gacouin A, et al. Neuromuscular blockers in early acute respiratory distress syndrome. N Engl J Med 2010;363(12):1107–16.
- Herridge MS, Tansey CM, Matte A, et al. Functional disability 5 years after acute respiratory distress syndrome. N Engl J Med 2011;364(14):1293–304.
- Herridge MS, Cheung AM, Tansey CM, et al. One-year outcomes in survivors of the acute respiratory distress syndrome. N Engl J Med 2003;348(8):683–93.
- Hemmila MR, Napolitano LM. Severe respiratory failure: advanced treatment options. Crit Care Med 2006;34(9 Suppl):S278–90.
- Guérin C, Reignier J, Richard J-C, et al. Prone positioning in severe acute respiratory distress syndrome. N Engl J Med 2013;368(23):2159–68.
- Sakr Y, Vincent JL, Reinhart K, et al. High tidal volume and positive fluid balance are associated with worse outcome in acute lung injury. Chest 2005;128(5):3098–108.
- National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network, Wiedemann HP, Wheeler AP, et al. Comparison of two fluid-management strategies in acute lung injury. N Engl J Med 2006;354(24):2564–75.
- Joint Trauma System, Hyperkalemia and Dialysis in the Deployed Setting CPG. 24 Jan 2017.https://jts.health.mil/index.cfm/PI_CPGs/cpgs Accessed Mar 2018.
- Park PK, Cannon JW, Ye W, et al. Transfusion strategies and development of ARDS in combat casualty care. J Trauma Acute Care Surg 2013;In press.
- Khan H, Belsher J, Yilmaz M, et al. Fresh-frozen plasma and platelet transfusions are associated with development of acute lung injury in critically ill medical patients. Chest 2007;131(5):1308–14.
- Netzer G, Shah C V, Iwashyna TJ, et al. Association of RBC transfusion with mortality in patients with acute lung injury. Chest 2007;132(4):1116–23.
- Watson GA, Sperry JL, Rosengart MR, et al. Fresh frozen plasma is independently associated with a higher risk of multiple organ failure and acute respiratory distress syndrome. J Trauma 2009;67(2):221–30.
- Hébert PC, Wells G, Blajchman MA, et al. A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. N Engl J Med 1999;340(6):409–17.
- Horita N, Hashimoto S, Miyazawa N, et al. Impact of Corticosteroids on Mortality in Patients with Acute Respiratory Distress Syndrome: A Systematic Review and Meta-analysis. Intern Med Tokyo Jpn 2015;54(12):1473–9.
- Meduri GU, Golden E, Freire AX, et al. Methylprednisolone infusion in early severe ARDS: results of a randomized controlled trial. Chest 2007;131(4):954–63.
- Tang BMP, Craig JC, Eslick GD, Seppelt I, McLean AS. Use of corticosteroids in acute lung injury and acute respiratory distress syndrome: a systematic review and meta-analysis. Crit Care Med 2009;37(5):1594–603.
- The National Heart, Lung and BIARDS (ARDS) CTN. Efficacy and Safety of Corticosteroids for Persistent Acute Respiratory Distress Syndrome. N Engl J Med 2006;354(16):1671–84.
- Shorr AF, Scoville SL, Cersovsky SB, et al. Acute eosinophilic pneumonia among US Military personnel deployed in or near Iraq. JAMA 2004;292(24):2997–3005.
- Joint Trauma System, Nutritional Support Using Enteral Parenteral Methods CPG, 04 Aug 2016. https://jts.health.mil/index.cfm/PI_CPGs/cpgs Accessed Mar 2018.
- Kress JP, Pohlman AS, O’Connor MF, Hall JB. Daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation. N Engl J Med 2000;342(20):1471–7.
- Pohlman MC, Schweickert WD, Pohlman AS, et al. Feasibility of physical and occupational therapy beginning from initiation of mechanical ventilation. Crit Care Med 2010;38(11):2089–94.
- Schweickert WD, Pohlman MC, Pohlman AS, et al. Early physical and occupational therapy in mechanically ventilated, critically ill patients: a randomised controlled trial. Lancet 2009;373(9678):1874–82.
- Beninati W, Meyer MT, Carter TE. The critical care air transport program. Crit Care Med 2008;36(7 Suppl):S370–6.
- Mason PE, Eadie JS, Holder AD. Prospective observational study of United States (US) Air Force Critical Care Air Transport team operations in Iraq. J Emerg Med 2011;41(1):8–13.
- Ingalls N, Zonies D, Bailey JA, et al. A review of the first 10 years of critical care aeromedical transport during operation iraqi freedom and operation enduring freedom: the importance of evacuation timing. JAMA Surg 2014;149(8):807–13.
- Bridges E, Evers K. Wartime critical care air transport. Mil Med 2009;174(4):370–5.
- Rodriquez Jr. D, Blakeman TC, Dorlac W, Johannigman JA, Branson RD. Maximizing oxygen delivery duringmechanical ventilation with a portable oxygen concentrator. J Trauma 2010:69 Suppl 1:S87-93.
- Bein T, Zonies D, Philipp A, et al. Transportable extracorporeal lung support for rescue of severe respiratory failure in combat casualties. J Trauma Acute Care Surg 2012;73(6):1450–6.
- Allan PF, Osborn EC, Bloom BB, Wanek S, Cannon JW. The introduction of extracorporeal membrane oxygenation to aeromedical evacuation. Mil Med 2011;176(8):932–7.
- Cannon JW, Zonies DH, Benfield RJ, Elster EA, Wanek SM. Advanced en-route critical care during combat operations. Bull Am Coll Surg 2011;96(5):21–9.
- Zimmermann M, Philipp A, Schmid FX, Dorlac W, Arlt M, Bein T. From Baghdad to Germany: use of a new pumpless extracorporeal lung assist system in two severely injured US soldiers. ASAIO J 2007;53(3):e4–6.
- Chung KK, Wolf SE, Renz EM, et al. High-frequency percussive ventilation and low tidal volume ventilation in burns: a randomized controlled trial. Crit Care Med 2010;38(10):1970–7.
- Peek GJ, Mugford M, Tiruvoipati R, et al. Efficacy and economic assessment of conventional ventilatory support versus extracorporeal membrane oxygenation for severe adult respiratory failure (CESAR): a multicentre randomised controlled trial. Lancet 2009;374(9698):1351–63.
- Davies A, Jones D, Bailey M, et al. Extracorporeal Membrane Oxygenation for 2009 Influenza A(H1N1) Acute Respiratory Distress Syndrome. JAMA 2009;302(17):1888–95.
- Guirand DM, Okoye OT, Schmidt BS, et al. Venovenous extracorporeal life support improves survival in adult trauma patients with acute hypoxemic respiratory failure: a multicenter retrospective cohort study. J Trauma Acute Care Surg 2014;76(5):1275–81.
- Arlt M, Philipp A, Voelkel S, et al. Extracorporeal membrane oxygenation in severe trauma patients with bleeding shock. Resuscitation 2010;81(7):804–9.
- Michaels AJ, Schriener RJ, Kolla S, et al. Extracorporeal life support in pulmonary failure after trauma. J Trauma 1999;46(4):638–45.
- Muellenbach RM, Kredel M, Kunze E, et al. Prolonged heparin-free extracorporeal membrane oxygenation in multiple injured acute respiratory distress syndrome patients with traumatic brain injury. J Trauma Acute Care Surg 2012;72(5):1444–7.
- Dorlac GR, Fang R, Pruitt VM, et al. Air transport of patients with severe lung injury: development and utilization of the Acute Lung Rescue Team. J Trauma 2009;66(4 Suppl):S164–71.
- Rubenfeld GD, Herridge MS. Epidemiology and outcomes of acute lung injury. Chest 2007;13 (2):554–62.
- Herridge MS, Tansey CM, Matte A, et al. Functional disability 5 years after acute respiratory distress syndrome. N Engl J Med 2011;364(14):1293–304.
- Salim A, Martin M, Constantinou C, et al. Acute respiratory distress syndrome in the trauma intensive care unit: morbid but not mortal. Arch Surg 2006;141(7):655–8.
- Shah CV, Localio AR, Lanken PN, et al. The impact of development of acute lung injury on hospital mortality in critically ill trauma patients. Crit Care Med 2008;36(8):2309–15.
- Treggiari MM, Hudson LD, Martin DP, Weiss NS, Caldwell E, Rubenfeld G. Effect of acute lung injury and acute respiratory distress syndrome on outcome in critically ill trauma patients. Crit Care Med 2004;32(2):327–31.
Додаток A: Діагностика і лікування ГРДС
Додаток B: Робота з апаратом ШВЛ згідно з результатами дослідження ARDSNET при лікуванні пацієнтів з ГРДС

Додаток C: Положення лежачи на животі для пацієнтів з ГРДС
Підготовка
- Переконайтесь у відсутності протипоказань.
- Переломи кісток обличчя або таза
- Рани або опіки передньої частини тулуба
- Нестабільність хребта
- Підвищений ВЧТ
- Підтвердьте розміщення ендотрахеальної трубки на основі актуальної КТ.
- Переконайтеся, що ендотрахеальна трубка та всі інвазивні лінії/монітори (грудні дренажні трубки, крапельниці, лінії центрального доступу) закріплені.
- Враховуйте, як забезпечити підтримку голови, шиї та плечового пояса пацієнта.
- Зупиніть харчування через зонд, очистіть шлунок, затисніть зонд для харчування і гастральний зонд.
- Підготуйте обладнання для аспірації дихальних шляхів.
- Підготуйте всі в/в трубки, катетери тощо для з’єднань у положенні лежачи на животі.
- Забезпечте достатню довжину трубок
- Перемістіть дренажні пакети на протилежний бік ліжка
- Перемістіть дренажні системи від грудної дренажної трубки між ноги
- Перемістіть в/в трубку до голови пацієнта на протилежному боці ліжка
Обертання
- Розмістіть персонал з обох боків і узголів’я ліжка.
- Збільшіть FiO2 до 1,0 і запишіть дихальний об’єм, хвилинну вентиляцію, показники максимального тиску / тиску плато.
- Розстеліть нову підстилку, помістіть пацієнта в положення лежачи на боці.
- Зніміть відведення ЕКГ і електроди. За потреби виконуйте аспірацію дихальних шляхів, ротоглотки і носової порожнини.
- Перейдіть до переведення пацієнта в положення лежачи на животі і помістіть його по центру ліжка.
- Поверніть обличчя пацієнта до апарата ШВЛ. Переконайтесь у відсутності перегинів і зміщення повітропроводів.
- Забезпечте належну підтримку обличчя/плечей; не допускайте контакту підкладки з очима/очними ямками.
- Забезпечте зручне положення рук пацієнта. Уникайте розгинання рук, яке може спричинити плечову плексопатію.
- Виконайте аускультацію грудної клітки для інтубації головного бронха; знову виміряйте дихальний об’єм і хвилинну вентиляцію.
- Повторно підключіть і відрегулюйте всі трубки, перевірте функції.
- Розмістіть відведення ЕКГ і електроди на спині.
- Нахиліть пацієнта у зворотне положення Тренделенбурга. Якщо можливо, кожні дві години злегка (200) перевертайте пацієнта на бік.
- Після кожної зміни положення документуйте стан шкіри на несучих поверхнях.
Додаток D: Додаткова інформація щодо застосування за незатвердженими показаннями згідно з метою CPG
Мета
Мета цього Додатка — надати роз’яснення політики та практики Міноборони щодо включення в настанови CPG «незатверджених» показань для продуктів, які були схвалені Управлінням з контролю якості продуктів харчування і лікарських засобів США (FDA). Це стосується незатверджених показань при застосуванні у пацієнтів, які належать до збройних сил.
Вихідна інформація
Використання продуктів, схвалених FDA, за незатвердженими показаннями, надзвичайно поширене в медицині США і зазвичай не регулюється окремими нормативними актами. Проте, згідно з федеральним законодавством, у деяких обставинах застосування схвалених лікарських засобів за незатвердженими показаннями підлягає нормативним актам FDA, що регулюють використання «досліджуваних лікарських засобів». До цих обставин належить використання в рамках клінічних досліджень, а також, у військовому контексті, використання за незатвердженими показаннями згідно з вимогами командування. Деякі види використання за незатвердженими показаннями також можуть підлягати окремим нормативним актам.
Додаткова інформація щодо застосування за незатвердженими показаннями згідно з CPG
Включення в Настанови CPG застосувань за незатвердженими показаннями не належить до клінічних випробувань і не є вимогою командування. Більше того, таке включення не передбачає, що армійська система охорони здоров’я вимагає, щоб лікарі, які працюють в структурах Міноборони, застосовували відповідні продукти за незатвердженими показаннями або розглядали їх як «стандарт лікування». Натомість, включення в Настанови CPG застосувань за незатвердженими показаннями допомагає відповідальним медичним робітникам виконувати клінічну оцінку завдяки інформації про потенційні ризики та переваги альтернативних видів лікування. Рішення щодо клінічної оцінки належить відповідальному медичному працівнику в рамках відносин «лікар — пацієнт».
Додаткові процедури
Виважений розгляд
Відповідно до вказаної мети, при розгляді застосувань за незатвердженими показаннями в Настановах CPG окремо вказується, що такі показання не схвалені FDA. Крім того, розгляд підкріплений даними клінічних досліджень, в тому числі інформацією про обережне використання продукту та всі попередження, видані FDA.
Моніторинг забезпечення якості
Процедура Міноборони щодо застосувань за незатвердженими показаннями передбачає регулярний моніторинг забезпечення якості з реєстрацією результатів лікування та підтверджених потенційних побічних явищ. З огляду на це ще раз підкреслюється важливість ведення точних медичних записів.
Інформація для пацієнтів
Належна клінічна практика передбачає надання відповідної інформації пацієнтам. У кожних Настановах CPG, що передбачають застосування за незатвердженими показаннями, розглядається питання інформації для пацієнтів. За умови практичної доцільності, слід розглянути можливість включення додатка з інформаційним листком для пацієнтів, що видаватиметься до або після застосування продукту. Інформаційний листок має в доступній для пацієнтів формі містити такі відомості: a) це застосування не схвалене FDA; b) причини, чому медичний працівник зі структури Міноборони може прийняти рішення використати продукт з цією метою; c) потенційні ризики, пов’язані з таким застосуванням.






















