Вихідна інформація
У рамках даних настанов катастрофічна черепно-мозкова травма (ЧМТ) визначається як пошкодження мозку, яке, як очікується після оцінки методами візуалізації та/або при клінічному обстеженні, призведе до постійної втрати всіх функцій мозку вище рівня його стовбура.
ПРИМІТКА: У випадку пацієнтів із потенційно сумісною з життям, але тяжкою черепно-мозковою травмою (ЧМТ), дивіться Настанови з клінічної практики Об'єднаної системи лікування травм, “Нейрохірургія та тяжка травма голови” (Neurosurgery and Severe Head Injury) від 2 березня 2017 р.
- Метою цих настанов є надання корисних клінічних рекомендацій, що дозволять медичним працівникам на всіх етапах медичної допомоги, які стикаються з такими травмами, оптимізувати безпечну та належну евакуацію поранених на наступний рівень допомоги.
- Настанови не розглядають питання визначення смерті мозку, а також того, на якому етапі медичної допомоги та яким медичним спеціалістом це повинно бути встановлено.
- За умови проведення відповідних заходів ресусцитації та нормалізації гемодинаміки такі пацієнти мають більше шансів на возз’єднання зі своїми сім’ями в установах четвертого етапу медичної допомоги. Крім того, евакуація із зони бойових дій зберігає можливість для вшанування висловленого пацієнтом наміру бути донором органів. Досвід Регіонального медичного центру міста Ландштуль у період з 2003 по 2013 роки продемонстрував таку можливість, що дозволило закладу залишатися на одному рівні з провідними центрами континентальних штатів США. (Чернетка публікації, J. Oh, особисте спілкування, 5 серпня 2016 р.)
Катастрофічна ЧМТ пов’язана з глибокими фізіологічними змінами, які призводять до дифузних порушень судинної регуляції та поширеного ушкодження клітин. Крім цього, часто виникають серйозні порушення з боку обміну речовин, ендокринних та імунних функцій, а також розвиваються коагулопатії. Без належного лікування, у більш ніж 60% пацієнтів, такі розлади часто призводять до поліорганної недостатності, серцево-судинного колапсу та асистолії.
Із результатів проведених на тваринах досліджень відомо, що описане погіршення роботи серцево-судинної системи пов’язане з порушенням утилізації кисню, переходом від аеробного до анаеробного метаболізму, виснаженням запаів глікогену та високоенергетичних запасів міокарда, а також накопиченням лактату. Патологічні зміни метаболізму асоціюються з низьким рівнем трийодтироніну (Т3), тироксину (Т4) і, меншою мірою, кортизолу та інсуліну. Замісна терапія препаратами Т3 була пов’язана з повним відновленням аеробного метаболізму та наступною стабілізацією серцевої функції при застосуванні в осіб із підтвердженою смертю мозку. Крім того, використання Т3 та подібних препаратів для заміщення гормонів щитоподібної залози було пов’язане зі значним покращенням стану серцево-судинної системи, зниженням потреби в інотропній підтримці та зменшенням кількості смертей донорів внаслідок серцевої нестабільності. Етіологія цього функціонального «гіпотиреозу» недостатньо вивчена, проте вона може бути наслідком зниження рівня тиреотропного гормону, спричиненого незворотнім пошкодженням гіпоталамуса та гіпофіза внаслідок ішемії.21 Іншим поясненням є зниження периферичної конверсії Т4 до його більш потужного аналога Т3, подібно до синдрому еутиреоїдної патології. Слід зазначити, що докази, які підтверджують ефективність замісної гормональної терапії у даній групі пацієнтів, не дозволяють зробити остаточних висновків. Незважаючи на те, що ця інформація продовжує досліджуватись, слід визнати, що рання ефективна загальноприйнята допомога при невідкладних станах є основою лікування таких пацієнтів.
Лікування
Лікування катастрофічної ЧМТ зосереджене на стабілізації гемодинаміки. Цей процес складається з трьох аспектів:
- Раннє визначення тяжкості ушкодження, оскільки тяжкість ЧМТ корелює з недостатністю гіпофізарно-надниркової системи, що призводить до гемодинамічної нестабільності.
- Проведення інтенсивної терапії для досягнення стабільної гемодинаміки на основі ступеня ЧМТ та пов’язаних з нею травм.
- Ресусцитація за допомогою рідин та препаратів крові, раннє використання вазопресорів і розгляд можливості застосування ендокринної/гормональної терапії у пацієнтів з рефрактерною гемодинамічною нестабільністю.
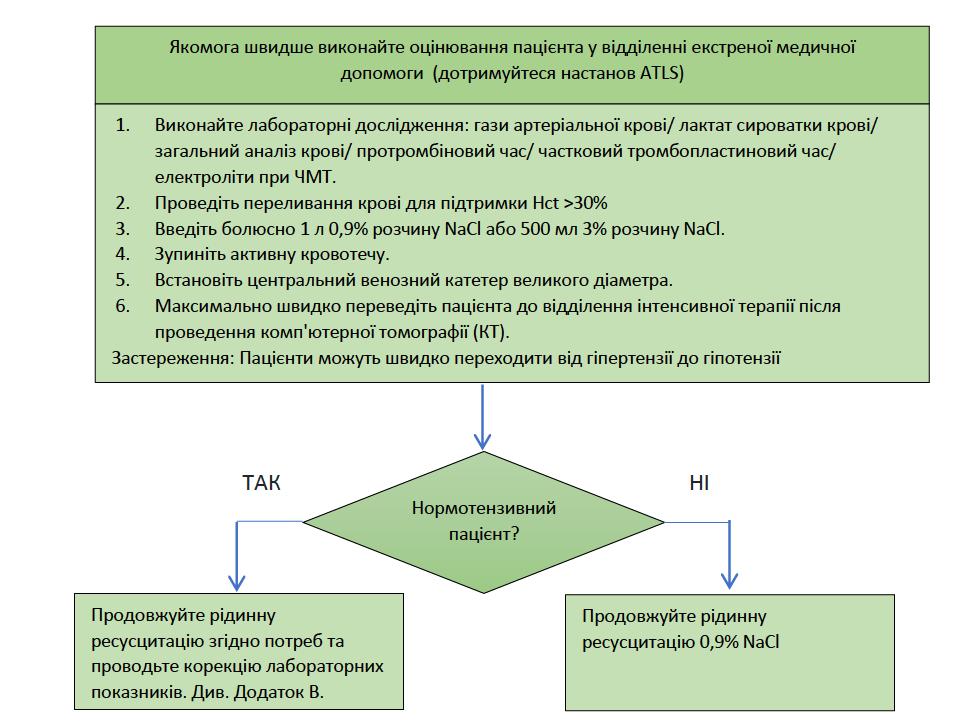
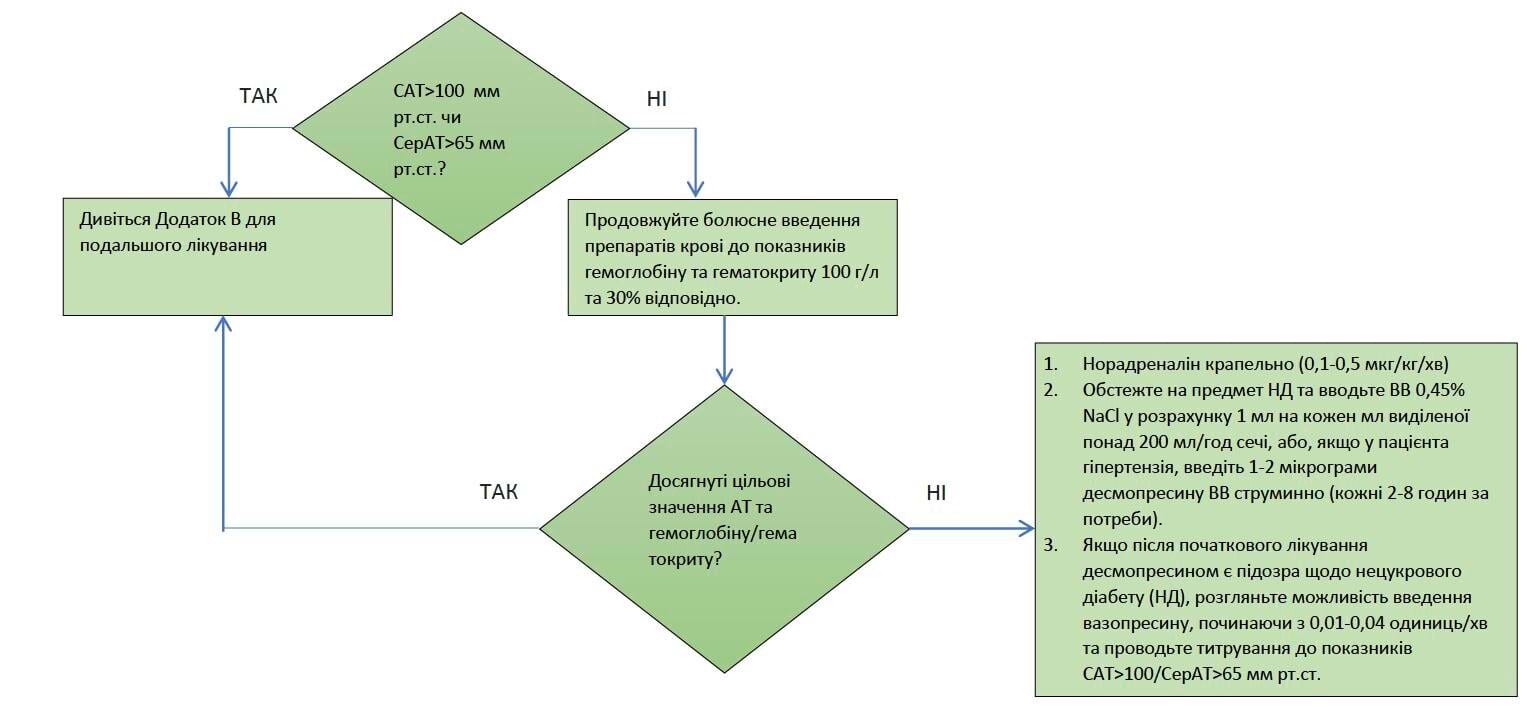
Вазопресори, такі як норадреналін, слід використовувати, якщо середній артеріальний тиск (СерАТ) залишається меншим за 70 мм рт.ст, незважаючи на належну рідинну ресусцитацію. (Див. Додаток А.) У пацієнтів із підозрою на нецукровий діабет (НД) слід розглянути можливість додавання вазопресину (крапельна інфузія) до норадреналіну після початкового лікування за допомогою десмопресину. (Див. Додаток А і Додаток B щодо лікування НД). У поранених із катастрофічною ЧМТ, які потребують більш, ніж одного вазопресора для підтримки систолічного артеріального тиску на рівні 100 мм рт.ст. або мають докази НД, слід серйозно розглядати варіант корекції пов'язаних із травмою ендокринних порушень, які можуть сприяти тривалій гемодинамічній нестабільності. (Див. Додаток B.) Додаткові засоби, які допомагають стабілізувати гемодинаміку, включають “стресову” дозу стероїдів, внутрішньовенне (ВВ) введення інсуліну та препарати гормонів щитоподібної залози.
Перелік додаткових препаратів:
- 1 ампула 50% декстрози (40% глюкози) ВВ
- 2 г метилпреднізолону ВВ
- 20 ОД звичайного інсуліну людини ВВ
- 20 мікрограмів тиреоїдного гормону (Т4) ВВ, за наявності
Введення відбувається у вигляді початкового болюсу з наступною безперервною інфузією 10 мкг/год Т4, якщо він доступний.
Необхідний агресивний підхід також має зосередитись на важливості раннього виявлення та лікування ускладнень, пов'язаних з катастрофічною ЧМТ, таких як:
- Дисеміноване внутрішньосудинне згортання (ДВЗ)
- Нецукровий діабет (НД)
- Нейрогенний набряк легень
- Гіпотермія
- Артимії
Див. Додаток C щодо лікування кожного з цих станів.
Переливання крові
Використання препаратів крові для цих пацієнтів є складною проблемою, пов’язаною з правильним використанням обмежених ресурсів в зоні бойових дій та нестачею доказових рекомендацій щодо даної теми. Якщо пацієнт реагує на попередні втручання змінами гемодинаміки, а його стан після початкового ураження є відносно стабільним, слід застосувати досить агресивний підхід для швидкої корекції коагулопатії; також необхідно виконати переливання еритроцитарної маси до рівня, достатнього для оптимізації доставки кисню до тканин і органів. Є небагато даних щодо підтримки оптимального рівня гемоглобіну в даній групі постраждалих, але для критично хворих осіб загалом, рекомендованим цільовим значенням є, щонайменше, 70 г/л. Однак у цьому протоколі цільовим рівнем гемоглобіну, встановленим для даної групи пацієнтів, є 100 г/л. (Див. Додаток A.) Інші препарати крові використовуються відповідно до стандартних протоколів відділення інтенсивної терапії для корекції вже існуючої травматичної коагулопатії або дисемінованого внутрішньосудинного згортання крові, спричиненого вивільненням тканинного фактора з некротизованої тканини мозку. Слід підтримувати показник міжнародного нормалізованого відношення (МНВ, INR) <1,5 та кількість тромбоцитів >50 000 до початку евакуації.
Визначення доречності/недоречності транспортування
Пацієнт, що реагує на ресусцитацію
У контексті катастрофічної ЧМТ, несумісної з життям: якщо пацієнт реагує на початкові заходи ресусцитації та лікування, а його стан вдається стабілізувати, слід розглянути можливість його транспортування до наступного вищого етапу надання допомоги. За цих обставин слід докласти рішучих зусиль для возз’єднання військовослужбовця з сім’єю в лікувальній установі четвертого етапу надання допомоги. В якості другорядного пріоритету, який слід розглядати лише у таких безнадійних ситуаціях, військовослужбовці також можуть бути оглянуті на предмет потенційного донорства органів у закладі четвертого етапу надання допомоги.
Пацієнт, що не реагує на ресусцитацію
У контексті катастрофічної ЧМТ, несумісної з життям: якщо пацієнт не реагує на початкові агресивні заходи ресусцитації, продовження подальших лікувальних зусиль має ґрунтуватися на поєднанні клінічного судження та загальної ситуації на полі бою, що включає: ресурси, доступні у лікувальному закладі поточного етапу медичної допомоги (кваліфікований у наданні допомоги при критичних станах персонал, обладнання, а також медичні матеріали та засоби); наявність інших тяжко поранених пацієнтів, які потребують негайної допомоги; очікування надходження поранених внаслідок активного бою; а також доступність і можливості евакуації до наступного вищого етапу надання допомоги.
За цих обставин слід рано залучати до організації медичної евакуації клінічне та оперативне керівництво. Команда з надання допомоги при травмі та команда аеромедичної евакуації повинні спільно обговорити клінічні особливості стану пораненого та можливість його транспортування. Клініцисти також повинні інформувати керівництво з медичних операцій, яке зможе надавати інформацію про розвиток подій на полі бою, що впливатимуть на доступність і місткість евакуаційного транспорту.
Якщо пацієнт не може бути клінічно стабілізований, або ситуація на полі бою перешкоджає транспортуванню, не слід докладати подальших зусиль у лікуванні. Припинення медичної підтримки зі збереженням гідності пораненого та забезпеченням його комфорту є проявом поваги та найбільш відповідними діями. Медичним працівникам, які мають таких пацієнтів, завжди рекомендують обговорювати їх ведення з колегами та місцевим медичним керівництвом, щоб досягти клінічного консенсусу в цих надзвичайно складних ситуаціях. Якщо це можливо та доцільно, медиків також заохочують до спілкування з фахівцями з травми на вищому етапі надання допомоги, аби досягти консенсусу стосовно того, транспортувати пацієнта, чи ні.
Такі ситуації, на щастя, не є поширеними, але становлять найбільш складну клінічну та етичну дилему, з якою можна зіткнутися на полі бою.
Показники покращення ефективності (ПЕ)
Досліджувана група
Усі пацієнти з черепно-мозковою травмою, з показником за шкалою AIS для голови >3, виписані із закладів третього або четвертого етапів медичної допомоги з балами за шкалою ШКГ=3, які померли впродовж наступних 30 днів.
Мета (очікувані результати)
- Безпечна евакуація пацієнтів досліджуваної групи на четвертий етап надання допомоги.
- Пацієнтам з катастрофічною ЧМТ надається медична допомога згідно з Настановами з клінічної практики.
Показники результативності/ дотримання рекомендацій
- Кількість і відсоток пацієнтів у досліджуваній групі, в яких є задокументована нейрохірургічна консультація.
- Кількість і відсоток пацієнтів з діагностованою смертю мозку на четвертому етапі надання допомоги, які є донорами органів.
Системна звітність та її частота
Згідно з даними настановами, вказане вище становить мінімальні критерії моніторингу ПЕ. Системна звітність проводитиметься щороку; додатковий моніторинг ПЕ та системну звітність можна проводити залежно від потреб.
Системний огляд та аналіз даних виконуватиме керівник Об’єднаної системи лікування травм (JTS) та відділ ПЕ JTS.
Обов'язки
Керівник команди з надання допомоги при травмах відповідає за ознайомлення з даними Настановами з клінічної практики, належне дотримання вказаних у ній вимог та моніторинг ПЕ на місцевому рівні.
-
- Power BM, Van Heerden PV. The physiological changes associated with brain death-- current concepts and implications for treatment of the brain dead organ donor. Anaesth Intensive Care. 1995;23:26-36.
- Smith M. Physiologic changes during brain stem death--lessons for management of the organ donor. J Heart Lung Transplant. 2004;23:S217-22.
- Salter DR, Dyke CM, Wechsler AS. Triiodothyronine (T3) and cardiovascular therapeutics: A review. J Card Surg. 1992;7:363-374.
- Novitzky D, Horak A, Cooper DK, Rose AG. Electrocardiographic and histopathologic changes developing during experimental brain death in the baboon. Transplant Proc. 1989;21:2567-2569.
- Cooper DK, Novitzky D, Wicomb WN. The pathophysiological effects of brain death on potential donor organs, with particular reference to the heart. Ann R Coll Surg Engl. 1989;71:261-266.
- Novitzky D, Cooper DK, Reichart B. Value of triiodothyronine (T3) therapy to braindead potential organ donors. J Heart Transplant. 1986;5:486-487.
- Novitzky D, Cooper DK, Reichart B. Hemodynamic and metabolic responses to hormonal therapy in brain- dead potential organ donors. Transplantation. 1987;43:852- 854.
- Wicomb WN, Cooper DK, Novitzky D. Impairment of renal slice function following brain death, with reversibility of injury by hormonal therapy. Transplantation. 1986;41:29-33.
- Novitzky D, Cooper DK, Morrell D, Isaacs S. Change from aerobic to anaerobic metabolism after brain death, and reversal following triiodothyronine therapy. Transplantation. 1988;45:32-36.
- Smrcka M, Mrlian A, Klabusay M. Immune system status in the patients after severe brain injury. Bratisl Lek Listy. 2005;106:144-146.
- Bredbacka S, Edner G. Soluble fibrin and D-dimer as detectors of hypercoagulability in patients with isolated brain trauma. J Neurosurg Anesthesiol. 1994;6:75-82.
- Pathak A, Dutta S, Marwaha N, Singh D, Varma N, Mathuriya SN. Change in tissue thromboplastin content of brain following trauma. Neurol India. 2005;53:178-182.
- Stein SC, Smith DH. Coagulopathy in traumatic brain injury. Neurocrit Care. 2004;1:479-488.
- Bayir A, Kalkan E, Kocak S, Ak A, Cander B, Bodur S. Fibrinolytic markers and neurologic outcome in traumatic brain injury. Neurol India. 2006;54:363-365.
- Nekludov M, Antovic J, Bredbacka S, Blomback M. Coagulation abnormalities associated with severe isolated traumatic brain injury: Cerebral arterio-venous differences in coagulation and inflammatory markers. J Neurotrauma. 2007;24:174-180.
- Affonseca CA, Carvalho LF, Guerra SD, Ferreira AR, Goulart EM. Coagulation disorder in children and adolescents with moderate to severe traumatic brain injury. J Pediatr (Rio J). 2007;83:274-282.
- Aiyagari V, Menendez JA, Diringer MN. Treatment of severe coagulopathy after gunshot injury to the head using recombinant activated factor VII. J Crit Care. 2005;20:176-179.
- Novitzky D, Cooper DK, Chaffin JS, Greer AE, DeBault LE, Zuhdi N. Improved cardiac allograft function following triiodothyronine therapy to both donor and recipient. Transplantation. 1990;49:311-316.
- Novitzky D. Novel actions of thyroid hormone: The role of triiodothyronine in cardiac transplantation. Thyroid. 1996;6:531-536.
- Zuppa AF, Nadkarni V, Davis L, et al. The effect of a thyroid hormone infusion on vasopressor support in critically ill children with cessation of neurologic function. Crit Care Med. 2004;32:2318-2322.
- Salim A, Martin M, Brown C, Belzberg H, Rhee P, Demetriades D. Complications of brain death: Frequency and impact on organ retrieval. Am Surg. 2006;72:377-381.
- Novitsky D, Cooper DKC, Rosendale JD, Kauffman HM. Hormonal therapy of the brain-dead organ donor: experimental and clinical studies. Transplantation. 2006; 82(11): 1396-1401
- Rech TH, Moraes RB, Crispin D, et. al. Management of the brain-dead organ donor: a systematic review and meta-analysis, Transplantation. 2013; 95(7): 966 -74.
- McKeown DW, Ball J. Treating the donor. Current Opinion in Organ Transplantation. 2014; 19:85-91.
- Powner DJ, Boccalandro C. Adrenal insufficiency following traumatic brain injury in adults. Curr Opin Crit Care. 2008 Apr;14(2):163-6.
- Klose M, Juul A, Poulsgaard L, Kosteljanetz M, Brennum J, Feldt-Rasmussen U. Prevalence and predictive factors of post-traumatic hypopituitarism. Clin Endocrinol (Oxf). 2007 Aug;67(2):193-201. Epub 2007 May
- Powner DJ, Boccalandro C, Alp MS, Vollmer DG. Endocrine failure after traumatic brain injury in adults. Neurocrit Care. 2006;5(1):61-70.
- Aimaretti G, Ambrosio MR, Di Somma C, Fusco A, Cannavò S, Gasperi M, Scaroni C, De Marinis L, Benvenga S, degli Uberti EC, Lombardi G, Mantero F, Martino E, Giordano G, Ghigo E. Traumatic brain injury and subarachnoid haemorrhage are conditions at high risk for hypopituitarism: screening study at 3 months after the brain injury. Clin Endocrinol (Oxf). 2004 Sep;61(3):320-6.
- Dimopoulou I, Tsagarakis S, Kouyialis AT, Roussou P, Assithianakis G, Christoforaki M, Ilias I, Sakas DE, Thalassinos N, Roussos C. Hypothalamic-pituitary-adrenal axis dysfunction in critically ill patients with traumatic brain injury: incidence, pathophysiology, and relationship to vasopressor dependence and peripheral interleukin-6 levels. Crit Care Med. 2004 Feb;32(2):404-8.
- Hebert PC, Wells G, Blajchman MA, et al: A multicenter, randomized, controlled clinical trial of transfusion requirements in critical care. Transfusion Requirements in Critical Care Investigators, Canadian Critical Care Trials Group. N Engl J Med 1999; 340:409-417.
- Kotloff RM, Blosser SD, Fulda GJ, et al: Management of the potential organ donor in the ICU: Society of Critical Care Medicine/ Americal College of Chest Physicians/ Association of Organ Procurement Organizations Consensus Statement. Crit Care Med 2015; 43:1291-1325.
Додаток А: Катастрофічна ЧМТ: Заходи ресусцитації при стійкій гіпотензії
Додаток B: Лікування катастрофічної ЧМТ
- Дисеміноване внутрішньосудинне згортання крові (ДВЗ)
Проведіть ранню корекцію порушень згортання крові (тромбоцитопенія, підвищення МНВ), до моменту клінічної маніфестації ДВЗ-синдрому.
- Нецукровий діабет (НД)
- Якщо у пацієнта нормальний тиск, натрій сироватки крові >150 ммоль/л та діурез >600 мл/год, введіть 1-2 мікрограми десмопресину для ВВ струминного введення (кожні 2-8 годин за потреби)
- Забезпечте заміщення виділеної сечі за допомогою 0,45% NaCl у розрахунку 1 мл на кожен мл виділеної понад 200 мл/год сечі (приклад: якщо діурез = 1000 мл, об'єм 0,45% NaCl = 800 мл).
- Якщо натрій сироватки крові пацієнта > 150 ммоль/л та діурез > 300 мл/год, забезпечте заміщення виділеної сечі за допомогою 0,45% NaCl у розрахунку 1 мл на кожен мл виділеної понад 200 мл/год сечі.
- Якщо у пацієнта гіпотензія, скористайтеся протоколом із Додатку А та розгляньте можливість додавання вазопресину (крапельно), якщо є підозра НД.
Підводні камені: Існує можливість помилкового припущення щодо збільшення діурезу внаслідок нецукрового діабету, хоча насправді це може бути дія діуретиків та/або маніту. Якщо у пацієнта низький тиск, забезпечте заміщення виділеної рідини за допомогою 0,9% NaCl або розчину Рінгера лактату. (Інший маркер НД: питома вага сечі < 1,005).
- Тахікардія та гіпертонія
Поява цих симптомів зазвичай відбувається до моменту повного вклинення головного мозку. Коригувати їх не потрібно. Різкі коливання артеріального тиску до та одразу після вклинення головного мозку є поширеними симптомами. Агресивне лікування гіпертензії тільки посилить гіпотензію, яка виникає пізніше згідно з патофізіологією процесу вклинення.
- Нейрогенний набряк легень
Може виникнути набряк легень, що призведе до зниження PaO2; за потреби збільшіть підтримку дихання на апараті ШВЛ. У випадку серйозних порушень оксигенації застосуйте підвищений позитивний тиск в кінці видиху (ПТКВ) і розгляньте використання розширених режимів ШВЛ, таких як вентиляція з періодичним зниженням тиску в дихальних шляхах (англ., APRV) або високочастотна вентиляція (ВЧ ШВЛ), якщо є. Однак, підвищення ПТКВ може зменшити церебральне венозне повернення, що слід враховувати при лікуванні нейрогенного набряку легень. Подібним чином, APRV призводить до пермісивної гіперкапнії, яка також є шкідливою для пацієнта з травмою голови. Після встановлення діагнозу нейрогенного набряку легень ідеальним варіантом є підтримка зниженого серцевого переднавантаження та обмеження ВВ введення рідин для мінімізації набряку, однак ці заходи повинні виконуватись із урахуванням потреб інших систем органів.
- Гіпокаліємія та/або гіперглікемія
За потреби використовуйте ковзні шкали (sliding scales).
- Протокол введення Т4
Багато пацієнтів мають дефіцит Т3/Т4 і потребують додаткового введення тироксину. У пацієнтів із тяжкою ЧМТ та стійкою артеріальною гіпотензією, незважаючи на адекватну інфузійну терапію та високі дози пресорів, розпочніть введення тироксину, якщо він доступний. (Додаток C: Протокол замісної терапії Т4) Майте на увазі, що після початку введення тироксину імовірно виникне потреба у агресивному заміщенні калію.
- Зупинка серця
Дотримуйтесь настанов ACLS щодо зупинки серця.
Додаток C: Протокол замісної терапії T4
- Рідинна ресусцитація до попередньо визначених кінцевих точок (ЦВТ > 7мм рт.ст., САТ > 100 мм рт.ст.)
- Перелийте кров, щоб досягти показників гемоглобіну та гематокриту 100 г/л та 30% відповідно.
- Скоригуйте електролітний дисбаланс
Передумова
Пацієнт потребує комбінованого введення вазопресорів сумарною дозою понад 15 мкг для підтримки систолічного артеріального тиску на рівні 100 мм рт.ст. після завершення попереднього лікування, інакше стає гемодинамічно нестабільним.
Протокол введення Т4
- Проведіть ВВ болюсне введення наступних препаратів, швидко один за одним:
- 1 амп 50% декстрози (40% глюкози)
- 2 г метилпреднізолону
- 20 ОД звичайного інсуліну
- 20 мкг тироксину (Т4)
- Розпочніть крапельне введення 200 мкг Т4, розведеного у 500 мл 0,9% NaCl (0,4 мкг/мл). Початкова швидкість - 25 мл (10 мкг) на годину. Забезпечте максимально можливе зниження дозування вазопресорів, а потім за необхідності скоригуйте дозу Т4 для підтримки бажаного тиску.
- Донорам вагою > 45 кг вводять вище вказану дозу
- Донорам вагою 20-35 кг вводять 13 мл = 5,2 мкг/год
- Донорам вагою 35-45 кг отримають 19 мл = 7,6 мкг/год
- Через 30-60 хв у пацієнтів може виникнути тахікардія з підвищенням температури тіла та артеріального тиску.
Уважно стежте за рівнем К+. Єдиним можливим ускладненням введення T4, відомим на даний час, є незвичайно висока потреба у К+ (в окремих випадках).
Додаток D: Додаткова інформація щодо не передбаченого інструкцією застосування лікарських засобів у настановах з клінічної практики
Мета
Мета цього Додатка — надати роз’яснення політики та практики Міністерства оборони США щодо включення в Настанови з клінічної практики «незатверджених» показів для продуктів, які були схвалені Управлінням з контролю якості продуктів харчування і лікарських засобів США (FDA). Це стосується використання препаратів не за призначенням для пацієнтів, які належать до Збройних сил США.
Вихідна інформація
Незатверджене (тобто «не за призначенням» - “off-label”) використання продуктів, схвалених FDA, надзвичайно поширене в медицині США і зазвичай не регулюється окремими нормативними актами. Проте, згідно з Федеральним законодавством, за деяких обставин застосування схвалених лікарських засобів за незатвердженими показами регулюється положеннями FDA про «досліджувані нові ліки». До цих обставин належить використання в рамках клінічних досліджень, а також, у військовому контексті, використання за незатвердженими показами згідно з вимогами командування. Деякі види використання за незатвердженими показами також можуть підлягати окремим нормативним актам.
Додаткова інформація щодо застосування за незатвердженими показами у настановах з клінічної практики
Включення до Настанов з клінічної практики використання медикаментів за незатвердженими показами не належить до клінічних випробувань і не є вимогою командування. Більше того, таке включення не передбачає, що Військова система охорони здоров’я вимагає від медичних працівників, які працюють в структурах Міноборони США, застосовувати відповідні продукти за незатвердженими показами або вважає це «стандартом медичної допомоги». Швидше, включення до CPGs використання засобів «не за призначенням» має поглиблювати клінічне судження відповідального медичного працівника шляхом надання інформації щодо потенційних ризиків та переваг альтернативного лікування. Рішення приймається на основі клінічного судження відповідальним медичним працівником у контексті відносин між лікарем і пацієнтом.
Додаткові процедури
Виважений розгляд
Відповідно до цієї мети, в обговореннях використання медикаментів «не за призначенням» в CPG конкретно зазначено, що це використання, яке не схвалено FDA. Крім того, такі обговорення є збалансованими у представленні даних клінічних досліджень, включаючи будь-які дані, які свідчать про обережність у використанні продукту, і, зокрема, включаючи усі попередження, видані FDA.
Моніторинг забезпечення якості
Що стосується використання «не за призначенням», діяльність Міністерства оборони США полягає у підтримці регулярної системи моніторингу забезпечення якості результатів і відомих потенційних побічних ефектів. З цієї причини підкреслюється важливість ведення точних клінічних записів.
Інформація для пацієнтів
Належна клінічна практика передбачає надання відповідної інформації пацієнтам. У кожних Настановах з клінічної практики, де йдеться про використання засобу «не за призначенням», розглядається питання інформування пацієнтів. За умови практичної доцільності, слід розглянути можливість включення додатка з інформаційним листком для пацієнтів, що видаватиметься до або після застосування продукту. Інформаційний листок має в доступній для пацієнтів формі повідомляти наступне: a) що дане застосування не схвалене FDA; b) причини, чому медичний працівник Міністерства оборони США може прийняти рішення використати продукт з цією метою; c) потенційні ризики, пов’язані з таким застосуванням.






















