Мета
- Визначити підхід для оптимальної нутритивної підтримки критично хворого або пораненого пацієнта.
- Встановити чіткі цілі для реалізації ентерального харчування.
- Надати розуміння існування різних сумішей для ентерального харчування та їх використання.
- Встановити показання для повного парентерального харчування.
Визначення
- Ентеральне харчування (ЕХ): Використання шляху через шлунок, дванадцятипалу кишку або тонку кишку для введення харчових компонентів з метою оптимізації/пришвидшення одужання та нормалізації фізіологічних функцій.
- Повне парентеральне харчування (ППХ): Харчовий субстрат у вигляді суміші вводиться внутрішньовенно для оптимізації/пришвидшення одужання та нормалізації фізіологічних функцій.
Рекомендації
- Отримайте консультацію клінічного дієтолога-нутриціолога щодо нутритивної оцінки, рекомендацій та співпраці у харчовій підтримці для всіх пацієнтів у відділенні інтенсивної терапії.
- Розгляньте можливість телемедичної консультації зі спеціалістом на наступному рівні медичної допомоги, якщо фахівці з нутритивної підтримки не доступні на місці.
- У пацієнтів, які не можуть самостійно споживати їжу, ентеральному харчуванню повинна надаватися перевага перед повним парентеральним харчуванням. Ентеральне харчування підтримує цілісність слизової оболонки кишківника та імунну систему.
- У порівнянні з парентеральним харчуванням, ЕХ у належним чином відібраних пацієнтів асоціюється зі зменшенням інфекційних ускладнень, скороченням тривалості перебування в лікарні та значним скороченням тривалості перебування у відділенні інтенсивної терапії.
- Важливо відзначити, що максимальна користь від ентерального харчування досягається за умови його раннього початку (протягом 48 годин після госпіталізації), і що користь не залежить від дози, тому навіть низька швидкість (краплинне) годування може покращити результати.1,2
Ентеральне харчування
Показання до ентерального харчування
- Усі пацієнти з травмою, які, очікувано, не зможуть самостійно і повноцінно перорально харчуватися в період довше 5-7 днів.
- Усі пацієнти, для яких пероральне харчування з добавками не задовольняє поточних нутритивних потреб (тобто, <50% розрахованих необхідних калорій протягом >3 днів.)
- Усі пацієнти з попередньо наявним харчовим дефіцитом (ненавмисна втрата >15% ваги або рівень альбуміну до травми <30 г/л) або віднесені до категорії «високого нутритивного ризику» на основі валідованої системи оцінки нутритивного ризику, та які не зможуть негайно відновити повний пероральний прийом їжі. Слід підкреслити, що для того, щоб альбумін був корисним як маркер адекватності нутритивної підтримки, його рівень слід визначати до травми. Однак, в бойових умовах попередній рівень альбуміну (до травми) навряд чи буде доступним. Крім того, альбумін, виміряний під час гострого захворювання, не слід використовувати як маркер харчування, оскільки він є білком гострої фази запалення і помітно знизиться протягом початкового періоду критичного захворювання. Початковий рівень пре-альбуміну відразу після травми також має мало користі, але послідовні визначення пре-альбуміну можуть бути корисними під час фази розрішення та відновлення. Пре-альбумін не слід перевіряти частіше, ніж раз на тиждень.1-4
Абсолютні протипоказання до ентерального харчування
- Високий ризик неоклюзійного некрозу кишківника
- Активний шок або ресусцитація, що триває
- Стійкий середній артеріальний тиск (СерАТ) < 60 мм рт. ст.
- Зростаюча потреба у вазоактивній підтримці для підтримки СерАТ > 60 мм рт. ст.
- Генералізований перитоніт
- Кишкова непрохідність
- Хірургічна резекція кишківника без відновлення неперервності
- Паралітична кишкова непрохідність
- Рефрактерні до медикаментів блювання/діарея
- Відома або підозрювана мезентеріальна ішемія
- Значна шлунково-кишкова кровотеча
- Незакрита фістула з великою кількістю виділень (High output fistula) 1-3
Відносні протипоказання до ентерального харчування
- Температура тіла <35.5°C
- Підозра на абдомінальний компартмент-синдром на основі показника тиску в сечовому міхурі >25 мм рт. ст. 1-3
Парентеральне харчування
Показання до парентерального харчування
- Неможливість задовольнити >50% потреби в калоріях ентеральним шляхом на 7 день після травми
- Будь-які наведені вище протипоказання до ентерального харчування, які утримуються, а також, якщо пацієнт не отримує нутритивної підтримки протягом 3 днів, або не очікується, що пацієнт почне ентеральне харчування протягом наступних 3-5 днів або й довше.
- Масивна резекція тонкої кишки з рефрактерністю до ентерального харчування.
- Фістула з великою кількістю виділень (High output fistula - більше 500 мл/день) після невдалої елементної дієти.
- Усі пацієнти з попередньо існуючим харчовим дефіцитом (ненавмисна втрата >15% ваги або рівень альбуміну до травми <30 г/л) або віднесені до категорії «високого нутритивного ризику» на основі валідованої системи оцінки нутритивного ризику (NUTRIC або іншої) та протипоказаннями чи непереносимістю ентерального харчування.1-4
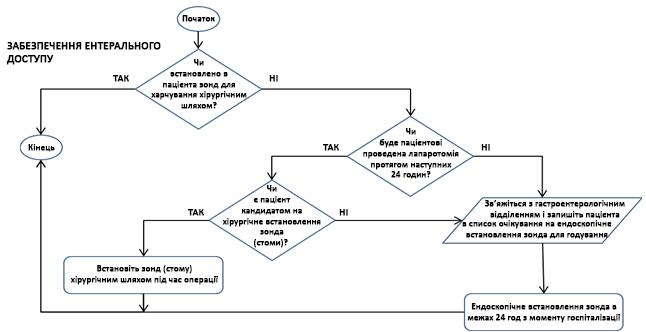
Ентеральний доступ
- Ентеральний доступ має бути забезпечений, в ідеалі, в межах 24 год з моменту госпіталізації до медичного закладу третього етапу допомоги або вище.1-3,5,6
- Якщо пацієнта буде доставлено в операційну кімнату в межах 24-48 годин після прибуття з метою проведення лапаротомії, назоєюнальний зонд необхідно встановити, поки пацієнт знаходиться в операційній. Хоча в цивільних умовах в інтубованих пацієнтів не спостерігається різниці в результатах, якщо порівнювати ЕХ через назоєюнальний та через шлунковий зонди, однак рекомендується ентеральний доступ дистальніше від шлунка, особливо у пацієнтів із ризиком аспірації. У зв’язку з періодичним характером годування через шлунок та потребою в частому утримуванні від прийому їжі при аеромедичній евакуації та/або проведенні процедур у бойовому середовищі, підкреслюється, що це НЕ є бажаний початковий метод годування таких пацієнтів. Однак, хоча це і непрактично, та для багатьох пацієнтів є прийнятно ініціювати ЕХ через шлунок. 1,3
- Якщо пацієнт не є кандидатом на оперативне встановлення зонда, використовуйте будь-які доступні засоби (наприклад, ендоскопічний, флюороскопічний метод тощо).
- За неможливості встановити назоєюнальний зонд, розгляньте можливість використання орогастрального (ОГ) або назогастрального (НГ) зонда, плануючи припинити ентеральне харчування за 6 годин до транспортування.
- Якщо очікується тривале ентеральне годування (>4 тижнів), слід розглянути можливість встановлення зонда для годування хірургічним шляхом. Гастростомія, єюностомія або комбінована гастроєюностомія повинні бути розглянуті до остаточного закриття операційної рани в усіх пацієнтів з відкритим черевним доступом; співвідношення ризиків проти переваг кожного варіанту разом із анатомічними особливостями шлунково-кишкового тракту пацієнта визначатимуть вибір хірургічного доступу для годування.1-6
Харчова потреба в енергії/білках
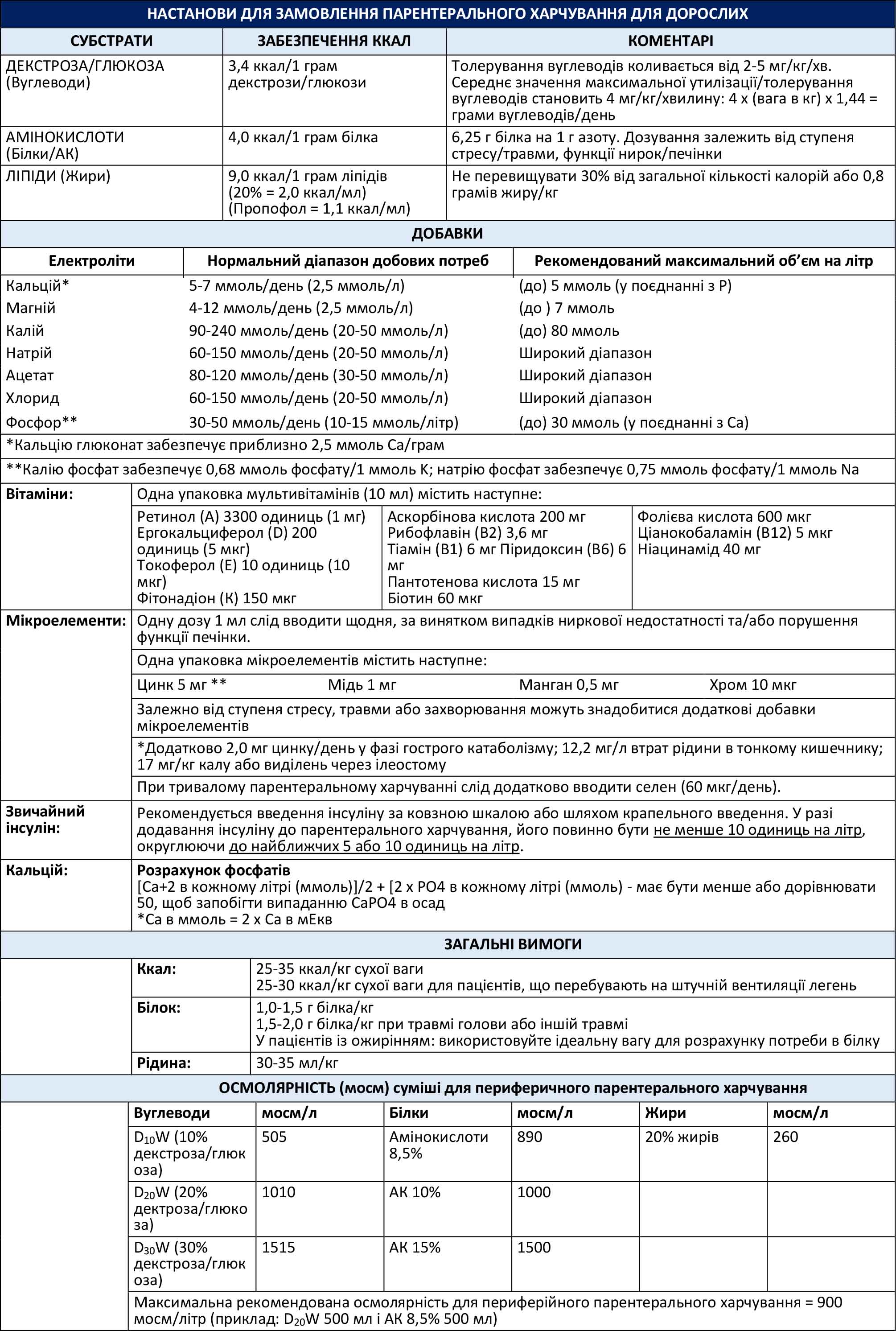
Харчові потреби в енергії/білках залежать від поточного статусу харчування пацієнта та тяжкості/типу перенесеної травми. Попередню практику перегодовування критично хворих або травмованих пацієнтів шляхом множення розрахованої цільової калорійності на певний «коефіцієнт стресу» або збільшення споживання калорій понад цільове значення, розраховане згідно з наведеними нижче рекомендаціями, НЕ слід застосовувати до пацієнтів у відділенні інтенсивної терапії. Це не має жодної нутритивної користі, і, натомість, пов’язане зі значним збільшенням ризику небажаних наслідків і ускладнень, пов’язаних із перегодовуванням. 1,2 У таблиці 1 наведено деякі базові рекомендації, а в таблиці 2 наведено рекомендації щодо вітамінних і мінеральних добавок.1-3
| Таблиця 1. Розрахунок ентерального харчування |
| Індекс маси тіла (ІМТ) | (маса тіла у кг)/(зріст у м)2 |
| Ідеальна вага | Чоловіки: (50 кг) + (2,3 кг на кожен дюйм понад 5 футів)
\ (50 кг) + (0.91 × [зріст в см − 152,4])
Жінки: (45,5 кг) + (2,3 кг на кожен дюйм понад 5 футів)
\ (45,5 кг) + (0.91 × [зріст в см − 152,4] |
| Ккал | Травматичні ушкодження, що супроводжуються значним стресом для організму/Опіки: 25-35 ккал/кг/день сухої ваги |
| Штучна вентиляція легень (>72 годин) або ГРДС: 20-25 ккал/кг/день сухої ваги |
| Ожиріння (ІМТ>30): 22-25 ккал/кг/день ідеальної ваги або 11-14 ккал/кг/день фактичної ваги |
| Білки | Значна травма/Опік/Черепно-мозкова травма: 1,5-2,0 г/кг/день
*При значних опіках може знадобитись до 1,5-2,0 г/кг/день |
| Ожиріння (ІМТ>30): 2 г/кг/день ідеальної ваги |
| Більшість пацієнтів: 1,2-1,5 г/кг/день |
| Жири | 15-30% ккал |
| 15-20% ккал при значних опіках |
| Вода (без електролітів та інших речовин) | 1 мл/ккал |
| Таблиця 2. Добавки вітамінів та мікроелементів |
| Продовжуйте протягом 7 днів, а потім повторно оцініть клінічний та нутритивний стан пацієнта.1,18-20 |
| ** Ретельно оцініть дозування у пацієнтів з нирковою та печінковою недостатністю. |
| Вітамін С | 500 мг внутрішньовенно, якщо кліренс креатиніну <30мл/год
Примітка: вищі дози вітаміну С можуть посилити або сприяти діареї |
| Сульфат цинку | 220 мг, таблетка перорально один раз на день протягом не більше двох тижнів |
| Вітамін Е | 1000-1200 МО перорально / через орогастральний / назогастральний / назоєюнальний зонд кожні вісім годин |
| Селен | 200 мкг внутрішньовенно або перорально /через орогастральний / назогастральний зонд кожні 24 годин |
| Мультивітамінні комплекси в таблетках, розчинах або внутрішньовенно один раз на добу | Пренатальні вітамінні комплекси часто є чудовим вибором, якщо також потрібна добавка заліза.
Пацієнти, які не можуть проковтнути велику таблетку або у кого залізо викликає розлад шлунково-кишкового тракту, добре переносять дитячі жувальні вітаміни. |
Особливі аспекти
Будьте уважні при оцінці пораненого військовослужбовця. Багато з них є молодими, здоровими та мають розвинену мускулатуру. Якщо вони мають м'язисту будову та ІМТ >30, потрібно використовувати їх розрахункову фактичну вагу (яка була до травми). Для тих, у кого ІМТ >30 через ожиріння, потрібно використовувати ідеальну вагу, як зазначено вище. Ви можете вибрати будь-яку з наведених вище формул, оскільки всі вони мають точність 70–80% порівняно з метаболічним дослідженням (картуванням), яке недоступне, доки пацієнт не прибуде до США, і яке слід використовувати якомога швидше, щоб отримати золотий стандарт потреби в калоріях та макроелементах.
Роль гіпокалорійного харчування
Незважаючи на те, що 25-35 ккал/кг/день широко використовується як цільова калорійність при годуванні важкохворих пацієнтів, зростає кількість даних, що припускають, що допустиме недоїдання з нижчими цільовими показниками калорійності є таким же ефективним, як і більш високі цільові показники калорійності, і може зменшити захворюваність через перегодовування або інші несприятливі наслідки повного нутритивного навантаження у пацієнта з метаболічним стресом. Останнім часом було опубліковано кілька рандомізованих контрольованих досліджень (EDEN та PERMIT)8-10 у змішаних групах критично хворих пацієнтів та лише в хірургічних пацієнтів тільки 11, що показали еквівалентні первинні результати гіпокалоричного (10 ккал/кг/день) харчування порівняно з нормокалорійним (25-35 ккал/кг/день). Однак, мета-аналіз показує покращення деяких вторинних показників при гіпокалорійному підході. На даний момент, гіпокалорійний підхід є обґрунтованим альтернативним варіантом у пацієнтів з низьким або середнім ризиком харчового дефіциту (на основі NUTRIC або іншої системи оцінки) та без попередньо наявного харчового дефіциту, і може зменшити деякі ускладнення, такі як непереносимість харчування, діарея та високий об'єм залишкового вмісту в шлунку. Додатково виявлено, що гіпокалорійне харчування (10-20 ккал/кг) має багато переваг у пацієнтів з попереднім ожирінням (ІМТ>30), зменшуючи надмірні жирові запаси та одночасно зберігаючи м'язову масу. Однак, надзвичайно важливо при використанні гіпокалорійного підходу у КОЖНОГО пацієнта пам'ятати, що "гіпокалорійний" відноситься до небілкових калорій, і така дієта завжди повинна забезпечувати повноцінне та достатнє надходження білків (зазвичай 1,5-2 грами/кг ідеальної ваги).1,2
Вибір суміші
- Концентрована суміш з високим вмістом білків (наприклад, IMPACT® або еквівалентна). Суміш із вмістом клітковини є протипоказаною пацієнтам з ризиком ішемії кишківника або гемодинамічною нестабільністю.1-3
- Використовувати для:
- Пацієнтів зі значною травмою протягом перших 7 днів нутритивної підтримки.
- Пацієнтів з помірним харчовим дефіцитом, яким проводяться великі планові втручання на стравоході, шлунку, підшлунковій залозі, органах гепатобіліарної системи або черевно-промежинна резекція/екстирпація прямої кишки.
- Пацієнтів з тяжким харчовим дефіцитом (пре-альбумін <100 мг/л), яким проводиться резекція товстого кишківника.
- Пацієнтів після тривалого голодування >6 днів.
- Пацієнтів з фістулою дистального відділу тонкого кишківника з великою кількістю виділень (більше 500 мл/день)
- Пацієнтів з опіками.
- Напівелементні/елементні ентеральні суміші (можуть містити трохи клітковини, помірну кількість білка та можуть бути доповнені Омега-3 жирними кислотами та/або пробіотиками). Напівелементні та елементні суміші легше перетравлюються/всмоктуються. (Наприклад, Vital®, Vital 1.2 AF®, Vital 1.5®, Peptamen®, Peptamen 1.5®, Peptamen AF - напівелементні; Vivonex®, Vital HN®). Використовувати, якщо є:
- Підтверджена непереносимість першої використаної суміші
- Стійка, тяжка діарея >48 годин
- Ушкодження підшлункової залози або дванадцятипалої кишки
- Помірне здуття >24 год
- Синдром короткого кишківника
- На розсуд лікуючого лікаря
- Полімерна суміш без клітковини (наприклад, Osmolite®1.0, 1.2, 1.5; Nutren® 1.0, 1.5,) - ізотонічна суміш для ентерального харчування з довголанцюговими білками, вуглеводами та нормальним вмістом жирів. Використовується для:
- Пацієнтів з помірною потребою в білках, нормальною травною і всмоктувальною здатністю шлунково-кишкового тракту.
- Полімерна суміш зі змішаним вмістом клітковини (Jevity 1.0, 1.2, 1.5, Fibersource HN, Nutren 1.0 Fiber, Nutrisource Fiber) — містить додану клітковину для сприяння утворенню більш сформованого калу. Використовується для:
- Стабільних пацієнтів на довготривалому лікуванні та тих, хто потребує заходів для профілактики закрепу (наприклад, пацієнти з параплегією).
- Інші формули включають:
- Isosource 1.5 — високобілкова висококалорійна суміш з клітковиною, концентрацією 1,5 ккал/мл для обмеження об’єму.
- Nepro — концентрована суміш (1,8 ккал/мл) з нижчим вмістом калію, магнію і фосфору; терапевтичне харчування зі змішаною клітковиною для пацієнтів на діалізі.
- Promote, Replete: Високобілкова полімерна суміш із вмістом 1,0 ккал/мл. Підходить для використання у пацієнтів, які переносять стандартну суміш, але потребують додаткового білка та не потребують концентрованого продукту.
- Додаткове джерело клітковини: призначайте, якщо потрібна додаткова клітковина для покращення формування калу та процесів дефекації, використовуйте розчинні форми (наприклад, Nutrisource Fiber® або еквівалент).
- Додаткове джерело білка: використовуйте, якщо потрібно додатковий білок, а калорійні потреби вже задовольняються обраною ентеральною сумішшю (наприклад, Beneprotein®, ProMod®, ProStat®). Вміст білка залежить від джерела білка, що використовується.
Початок та корекція ентерального харчування
Протоколи годування, основані на обʼємному методі та підході “зверху-вниз”
Серед багатьох проблем із забезпеченням "цільової" дози ентеральних калорій є припинення зондового годування під час втручань, "непереносимість" пацієнтом, зміщення трубки, діарея, переведення в інше відділення/заклад, проведення візуалізаційних досліджень та інші звичні для ВІТ події. Покращення забезпечення цільових калорій систематично демонструється при використанні протоколізованого підходу, який має на меті мінімізувати перерви та дозволяє медичному персоналу (медсестрі ВІТ) адаптовувати режим харчування, щоб забезпечити досягнення цільових калорій. “Заснований на об’ємі” протокол зосереджений на доставці денного обʼєму ентерального живлення, а не на годинній швидкості, що дозволяє регулювати швидкість введення або призначати додаткові болюси, щоб компенсувати втрати обʼєму при зупинці або перериванні ентерального харчування.1 При ініціюванні та корекції ентерального харчування рекомендовано:
- Розпочніть ентеральне годування через зонд повноцінною сумішшю зі швидкістю 20 мл/год.
- Збільшуйте швидкість на 20 мл/год кожні 6-8 годин до цільової норми при низькому ризику непереносимості
- При високому ризику непереносимості ентерального годування, “відкритому животі” або наявній важкій кишковій непрохідності, підтримуйте швидкість харчування (20-30 мл/год) протягом перших 24 годин, а потім продовжуйте при добрій переносимості.
- Для пацієнтів з ОПІКОВОЮ травмою та травмою ГОЛОВИ без абдомінальної травми чи інших протипоказань, збільшуйте на 20 мл кожні 4 години до цільової норми.
ПРИМІТКА: При швидкому переведенні пацієнта з одного рівня медичної допомоги на наступний (наприклад, зі станції передової бази (Forward Operating Base, FOB) на рівень 3, а потім на рівень 4 (наприклад, до Ландштульського регіонального медичного центру (Landstuhl Regional Medical Center, LRMC)), переносимість годування під час аеромедичної евакуації або під час транспортування аеромедичною бригадою інтенсивної терапії (Critical Care Air Transport Team, CCATT) контролювати важко. Краще не розпочинати годування до того моменту, коли пацієнт буде знаходитись на одному місці хоча б 24 години. Ризик аспірації у притомного пацієнта або ризик непереносимості в інтубованого пацієнта є реальним і вимагає відповідного повторного обстеження, поки не буде встановлена добра переносимість годування перед будь-якими перельотами.
Глутамін
Загалом, добавки глутаміну не повинні використовуватись у критично хворих пацієнтів, включно з критично хворими пацієнтами з бойовими травмами. Це суттєва зміна порівняно з попередніми настановами з клінічної практики.3 Основним аргументом на користь добавок глутаміну є те, що критично хворі пацієнти часто мають знижені рівні глутаміну при госпіталізації до ВІТ, а низький рівень глутаміну в плазмі пов'язаний зі збільшенням смертності, а також існують докази на користь того, що добавки глутаміну можуть зменшити ризик інфекційних ускладнень.1,2,13-15 Однак, останні дослідження свідчать про те, що використання добавок глутаміну суттєво збільшує рівень смертності у критично хворих пацієнтів, особливо тих, хто має значні ознаки органної дисфункції.14-16 Роль добавок глутаміну у харчуванні хворих з травмами та опіками менш зрозуміла. Докази щодо переваг добавок глутаміну у пацієнтів з травматичними ушкодженнями суперечливі; останній мета-аналіз стосовно глутаміну в ентеральному харчуванні пацієнтів з травмою не виявив переваг щодо смертності, але виявив тенденцію до зменшення інфекційних ускладнень. Ми рекомендуємо утриматись від введення ентерального чи парентерального глутаміну критично хворим пацієнтам з бойовими травмами. Єдина група, для якої можна розглядати застосування добавок глутаміну, - це пацієнти з ізольованою опіковою травмою без ознак сепсису або мультиорганної дисфункції.1,16,17 Очікуються результати великого багатоцентрового рандомізованого дослідження (RE-ENERGIZE), яке визначить подальше використання добавок глутаміну в пацієнтів з опіками.
Ентеральні добавки для пацієнтів, які добре переносять дієту
Багато пацієнтів з травматичними ураженнями можуть добре переносити звичайну дієту. Проте, з різних причин, наприклад, оперативні втручання, періоди відновлення після операцій, знижений апетит через прийом медикаментів та інше, пацієнти можуть бути часто змушені утримуватись від прийому їжі. Питні добавки у пацієнтів, які можуть їсти, допомагають дещо компенсувати дефіцит калорій та мають нутритивні терапевтичні переваги, важливі при існуванні обмежених періодів недостатнього прийому їжі.
- Рекомендовані напої з високим вмістом білків (наприклад, Ensure Plus®, Boost Plus®, Impact© Advanced RecoveryTM або еквівалентні) можуть бути додані до їжі у дозі 0,5-1,0 л на день (2-4 напої).
- Немає доказів користі від рутинного призначення ентерального харчування для пацієнтів з низьким нутритивним ризиком, які мають короткочасні (<48 годин) періоди без їжі та пиття.
- Для пацієнтів з помірним та високим нутритивним ризиком або попередньо наявним харчовим дефіцитом, прийом оральних поживних речовин між періодами без їжі та пиття повинен бути максимальний, а у випадку недостатнього ефекту від перорального прийому їжі або наявності ознак погіршення нутритивних показників (наприклад, втрата ваги, зниження рівня преальбуміну, втрата м'язової маси) слід розглянути перехід на повне парентеральне харчування.
Загальні особливості (харчування через шлунок)
Загальні особливості щодо пацієнтів, які отримують харчування через шлунок1:
- Харчування через шлунок може бути необхідним при ініціюванні раннього ентерального харчування, але воно категорично не рекомендоване в пацієнтів з бойовою травмою під час етапу швидкого транспортування на континентальну територію США.
- Якщо клінічна ситуація потребує розгляду доцільності харчування через шлунок, це необхідно обговорити з хірургом-травматологом та забезпечити координацію з усією мультидисциплінарною командою.
- Перед припиненням ентерального харчування слід спробувати застосувати прокінетичні засоби для максимального підвищення толерантності до ентерального харчування.
- Можна орієнтуватися на залишковий обʼєм шлунка (ЗОШ), але годування не повинно припинятися, якщо ЗОШ є менше 500 мл.
Загальні особливості (харчування через порожню кишку)
Загальні особливості щодо пацієнтів, які отримують ентеральне харчування через порожню кишку (відділ тонкого кишечника):
- Постійно підтримуйте узголів’я >30 градусів або зворотне положення Тренделенбурга при сумнівах щодо травми хребта.
- У межах 12 годин після кожного аеромедичного транспортування чи перевезення виконайте рентгенгенограму черевної порожнини за допомогою портативного апарата, щоб переконатись, що зонд знаходиться в тонкій кишці.
- Ентеральне харчування через порожню кишку (дистальніше зв’язки Трейтца), НЕ повинне припинятись перед переведенням в операційну, діагностичними тестами, транспортуванням командою ССАТ/аеромедичною евакуацією чи проведенням процедур у горизонтальному положенні тощо.
- Прикріпіть орогастральний зонд до аспіратора і увімкніть в режимі повільної інтермітуючої аспірації під час ініціації та коригування подачі харчування через назоєюнальний зонд.
Догляд за назоєюнальним зондом
- Зважаючи на розмір (8-12F) назоєюнального зонда, необхідний ретельний догляд, щоб запобігти закупорюванню трубки. Це легко контролюється шляхом промивання трубки кожні 2 години та ПЕРЕД і ПІСЛЯ введення всіх медикаментів.
- Забивання/закупорювання виникає внаслідок нашарування часток харчової суміші на стінки назоєюнального зонда або неналежного введення медикаментів.
- Об'єм трубки настільки малий, що жодна кількість панкреатичних ферментів, бікарбонату, кóли тощо не є ефективною для збереження просвіту тривалий час. Запобігання накопиченню залишків є необхідним для забезпечення функціональності трубки.
- Рекомендується очищати трубку за допомогою 20 мл води (можна використовувати попередньо набрані фізіологічним розчином шприци) кожні дві години, а також ПЕРЕД і ПІСЛЯ введення всіх лікарських засобів. Об'єм може бути збільшений, якщо цього вимагає стан хворого та є відповідна потреба в рідині.
- Для пацієнтів, які, ймовірно, потребуватимуть тривалого ентерального харчування (>4 тижнів), або які не толерують назоентеральний зонд, наполегливо рекомендується хірургічне створення стоми для годування, якщо немає абсолютних протипоказань. У пацієнтів, які потребують тривалого ентерального годування, надається перевага гастростомії над єюностомією через простоту ведення, повсякденного догляду та переходу до спрощеного болюсного режиму годування через зонд.
Загальні особливості (парентеральне харчування)
- Повне парентеральне харчування (ППХ), зазвичай, не доступне в зоні ведення бойових дій.
- Застосовуйте ППХ лише за умови, що ентеральне харчування неможливе або не здатне забезпечити мінімальні розрахункові потреби в калоріях.1
- Загальні початкові рекомендації для введення ППХ: 20-25 ккал/кг. Початкова доза декстрози (глюкози) - 150 г при наявності цукрового діабету, 200 г, якщо його немає. Збільшуйте на 50 г/день при гарному глікемічному контролі. Швидкість інфузії глюкози спочатку становить 2-3 мг/кг/хв. Кількість внутрішньовенних ліпідів не повинна перевищувати 1 г/кг/д. При рівні тригліцеридів > 400 мг/дл (4,5 ммоль/л) необхідно припинити введення внутрішньовенних ліпідів. При рівні загального білірубіну >4 мг/дл (68,4 мкмоль/л) мікроелементи слід вводити лише 1-2 рази на тиждень.
- Переконайтеся, що у пацієнта є прохідний окремий центральний катетер або центральний катетер, встановлений через периферичні вени (PICC), для введення ППХ.
- При використанні ППХ без ліпідів, необхідно використовувати інфузійний фільтр з діаметром пор 0,2 мікрона, а при використанні парентерального харчування з ліпідами - фільтр з діаметром пор 1,2 мікрона.
Особливості щодо медикаментів
Інотропні засоби (наприклад, добутамін, мілринон)
Не рекомендовано вносити зміни до плану харчування. Продовжуйте згідно протоколу харчування.
Міорелаксанти, вазоактивні засоби
(Включені наступні засоби, але перелік не обмежується ними: наприклад, вазопресин >0,04 одиниць/хв, дофамін >10 мкг/кг/хв, норадреналін >5 мкг/хв, фенілефрин >50 мкг/хв, адреналін у різних дозах)
- Елементна суміш зі швидкістю 20 мл/год - не збільшувати швидкість.
- Розглянути необхідність початку повного парентерального харчування з 7-го дня після травми при непереносимості ентерального харчування або неможливості досягнення цільової швидкості.
- Розглянути ранній початок ППХ у пацієнтів з високим нутритивним ризиком або попередньо наявним харчовим дефіцитом.
- Зупинити ентеральне харчування при додаванні вазопресорів, збільшенні доз вазопресорів або стійкому СерАТ <60 мм рт.ст.
Лабораторна оцінка
- У пацієнтів, що перебувають у ВІТ більше 7 днів, оцінюйте рівень пре-альбуміну щопонеділка.
- У пацієнтів на повному парентеральному харчуванні визначайте показники функцій печінки та ліпідограму на початку лікування та щопонеділка.
Ведення пацієнта з непереносимістю ентерального харчування
(Див. Додаток А)
Блювання
- Якщо орогастральний або назогастральний зонд не встановлено, встановіть його, приєднайте до аспіратора та утримуйте в режимі повільної інтермітуючої аспірації.
- Перевірте функціонування та правильність розташування оро- або назогастрального зонда.
- Якщо зонд знаходиться у правильному положенні та працює належним чином, зменшіть швидкість подачі харчування на 50% та повідомте лікаря для подальшої оцінки та корекції.
- Переконайтеся в адекватній роботі кишечника (збережена ізоперистальтика з ефективним пасажем їжі та випорожненнями).
- Якщо пацієнт отримує харчування через шлунок, розгляньте можливість встановлення зонда дистальніше пілоруса.
Здуття живота (від легкого до помірного)
- Зберіть анамнез та проведіть фізикальний огляд.
- Підтримуйте поточну швидкість подачі харчування та не збільшуйте її.
- Виконайте рентгенографію органів черевної порожнини за допомогою портативного апарата для виключення тонко/товстокишкової непрохідності.
- Забезпечте заходи для адекватного випорожнення кишківника та уникнення закрепу.
- При збереженні здуття >24 год та відсутності протипоказань до продовження годування через зонд, перейдіть на елементну суміш.
- Якщо пацієнт отримує низькі дози вазопресорів, і під час годування виникло або збільшилось здуття живота - це має спонукати до припинення годування через зонд та виключення ішемії кишечника.
Тяжке здуття
- Зберіть анамнез та проведіть фізикальний огляд.
- Припиніть годування через зонд.
- Контролюйте баланс рідини.
- Розгляньте необхідність обстеження: загальний аналіз крові, лактат, гази артеріальної крові, Chem7 (азот сечовини, CO2, креатинін, глюкоза, хлор, калій, натрій), рентгенографія нирок, сечоводів і сечового міхура, КТ органів черевної порожнини.
- Перевірте тиск в сечовому міхурі.
Діарея
- При помірній (3-4 рази/24 год або 400-600 мл/24 год) або важкій діареї (>4 рази/24 год або >600 мл/24 год), розгляньте такі дії:
- Перегляньте записи про отримані медикаменти щодо можливих причин діареї.
- Проведіть рентгенологічне дослідження черевної порожнини для оцінки розташування зонда.
- Розгляньте можливість обстеження пацієнта на Clostridium difficile (C. diff.). Якщо є докази інфекції C. diff., лікуйте пероральним метронідазолом або пероральним ванкоміцином в залежності від тяжкості. Протидіарейні препарати слід застосовувати з великою обережністю у пацієнтів з інфекцією C.diff.; вони повинні розглядатися лише у пацієнта з контрольованою інфекцією або вже при покращенні стану.
- Контролюйте рівень рідини та електролітів.
- Розгляньте призначення розчинної клітковини (наприклад, гуарової гуми, 1 пакетик двічі на день, збільшуйте до 1 пакетика чотири рази на день, якщо консистенція випорожнень не покращується за 2-3 дні).
- За відсутності доказів наявності C. diff., розгляньте призначення 2 мг лопераміду після кожного рідкого випорожнення. Альтернативою є кодеїн 15 мг.
Велика кількість аспірату через оро-/назогастральний зонд
(>1200 мл / 24 години) через оро-/назогастральний зонд при безперервній аспірації та годуванні через назоєюнальний зонд.
- Припиніть годування через зонд
- Виконайте рентгенографію органів черевної порожнини для визначення положення оро-/назогастрального зонда та назоєюнального зонда.
- Переконайтеся, що оро-/назогастральний зонд знаходиться в шлунку. Якщо зонд просунувся дистальніше пілоруса, відтягніть його назад у шлунок і відновіть годування через зонд з попередньою швидкістю.
- Переконайтеся, що назоєюнальний зонд знаходиться у правильному положенні. Якщо назоєюнальний зонд знаходиться в шлунку, вживіть відповідних заходів, щоб перемістити його у належне положення. Якщо назоєюнальний зонд перебуває у правильному положенні, зменшіть подачу через зонд на 50% і оцініть загальний стан пацієнта.
- Перевірте аспірат з оро-/назогастрального зонда на рівень глюкози.
- Якщо глюкоза >6,1 ммоль/л, припиніть годування через зонд на 12 годин і повторіть аналіз.
- Якщо аналіз на глюкозу негативний, відновіть годування через зонд із швидкістю, наполовину меншою за попередню.
Збільшення обʼєму залишкової рідини в шлунку
(При годуванні через шлунок або годуванні дистальніше пілоруса (постпілорично))
- При годуванні через оро-/назогастральний зонд, або якщо встановлено додатково оро-/назогастральний зонд (при годуванні через назоєюнальний або постпілоричний зонд), перевіряйте обʼєм залишкової рідини в шлунку кожні 4-8 годин.
- Переконайтеся, що немає ознак нової кишкової непрохідності (тобто зменшена частота/кількість випорожнень, електролітні порушення, нещодавня операція на черевній порожнині, абдомінальний компартмент-синдром, інфікування C.difficile тощо).
- Повторно влийте весь шлунковий аспірат або введіть еквівалентний об’єм 0,45% NaCl.
- Якщо при двох послідовних вимірюваннях обʼєм залишкової рідини > 300 мл, повідомте лікаря.
- Розпочніть лікування еритроміцином 250 мг внутрішньовенно або перорально кожні 6 годин або метоклопрамідом 10 мг внутрішньовенно кожні 6 годин і продовжуйте вимірювати обʼєм залишкової рідини кожні 4 години.
- Припиняйте ентеральне харчування тільки за призначенням лікаря.
Профілактика закрепу
У пацієнтів з високим ризиком розвитку гострого закрепу слід розпочати застосування заходів для профілактики закрепів. Якщо пацієнт отримує харчування через зонд і має менше одного акту випорожнення за два дні, слід розпочати протокол з догляду за кишківником. Протокол з догляду за кишківником також може бути розпочатий емпірично на початку ентерального харчування у пацієнтів з високим ризиком розвитку закрепу.
Гострий закреп
Критерії включення для пацієнтів з високим ризиком виникнення гострого закрепу:
- Опіоїди
- Іммобілізація
- Порушення дієти та вживання рідини
- Стрес
- Закреп в анамнезі
Відносні протипоказання
- Оперативне втручання на прямій кишці
- Біль в животі
- Алергія на медикаменти для запобігання закрепів
- Нейтропенія (абсолютна кількість нейтрофілів <1000/мм3 )
- Тромбоцитопенія (тромбоцити <30 000)
Абсолютні протипоказання
Підозра або підтверджена кишкова непрохідність
ПРИМІТКА: Якщо пацієнт мав лише 1 випорожнення кожних два дні, він відноситься до стадії 1 або лише потребує нагляду.
Перший етап
(При відсутності випорожнень протягом 48 год)
Оцінка стану пацієнта та ректальний огляд
- Наявний закреп: проведіть видалення затверділого вмісту вручну; застосуйте клізму з мильним розчином одноразово АБО бісакодил 10 мг (супозиторій) один раз на добу
- Відсутній закреп: докузат 100 мг перорально або через назоєюнальний зонд кожні 8 годин, а також препарати сени: 1 таблетка перорально або 5 мл через назоєюнальний зонд щоранку
- Якщо протягом 24 годин після початку першого етапу випорожнення відсутні або їх обʼєм дуже малий, перейдіть до другого етапу.
Другий етап
- Додайте свічки бісакодилу у дозі 10 мг один раз на добу, відмініть при появі випорожнень і продовжуйте дії першого етапу.
- Якщо протягом 24 годин немає випорожнень або їх обʼєм дуже малий, перейдіть до третього етапу.
- Якщо у пацієнта з’являються рідкі випорожнення або діарея, поверніться до першого етапу.
Третій етап
- Додайте молоко магнезії 30 мл перорально кожні 6 годин або Міралакс 17 г перорально або через назоєюнальний зонд двічі на добу до появи випорожнень, після чого відмініть (уникайте застосування молока магнезії при нирковій недостатності). Поверніться до другого етапу.
- Якщо через 24 години випорожнень немає або їх обʼєм дуже малий, перейдіть до четвертого етапу.
- Якщо у пацієнта з’являються рідкі випорожнення або діарея, поверніться до першого етапу.
Четвертий етап
- Зателефонуйте та повідомте лікаря.
- Проведіть рентгенографію органів черевної порожнини.
- Уточніть продовження терапії для догляду за кишківником.
Система для виведення калових мас
Для пацієнтів, які потребують використання систем для виведення калових мас (під час догляду за ранами) та/або контролю за випорожненнями, будь ласка, звертайтеся до інструкцій виробника. Використання систем для виведення калових мас повинно бути підтверджено лікарем-хірургом.
Моніторинг покращення ефективності (ПЕ)
Досліджувана група
Усі пацієнти у ВІТ
Мета (очікувані результати)
Встановлюється ентеральний доступ або розпочинається пероральне харчування в межах 24 годин з моменту госпіталізації в медичний заклад 3 рівня або вище (або є задокументовані протипоказання).
Показники результативності/Дотримання рекомендацій
Кількість і відсоток пацієнтів у досліджуваній групі, у яких встановлено ентеральний доступ або розпочата пероральна дієта в межах 24 годин після надходження до медичного закладу 3 рівня або вище.
Джерела даних
- Медична картка пацієнта
- Реєстр травм Міністерства оборони США (DoDTR)
Системна звітність та її частота
Вказане вище становить мінімальні критерії моніторингу ПЕ для цих Настанов. Системна звітність виконуватиметься щороку; додатковий моніторинг ПЕ та заходи із системної звітності будуть виконані залежно від потреб.
Системний перегляд та аналіз даних виконуватиме керівник Об’єднаної системи лікування травм та Відділ ПЕ JTS.
Обов'язки
Відповідальність керівника травматологічної команди полягає в тому, щоб забезпечити ознайомлення, відповідне дотримання та моніторинг ефективності цих клінічних настанов на локальному рівні.
-
- Taylor BE, McClave SA, Martindale RG, Warren MM, Johnson DR, Braunschweig C, McCarthy MS, Davanos E, Rice TW, Cresci GA, Gervasio JM, Sacks GS, Roberts PR, Compher C; Society of Critical Care Medicine and the American Society of Parenteral and Enteral Nutrition. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.).Crit Care Med. 2016;44 (2): 390-438.
- Critical Care Nutrition. Canadian Clinical Practice Guidelines 2015. 2015 http://www.criticalcarenutrition.com/docs/CPGs%202015/Summary%20CPGs%202015%20vs%202013.pdf. Accessed Aug 2020.
- Joint Trauma System, Nutrition Support of the traumatically injured patient, Jun 2012. (archived)
- Heyland DK, Dhaliwal R, Jiang X, Day AG. Identifying critically ill patients who benefit the most from nutrition therapy: the development and initial validation of a novel risk assessment tool. Critical Care. 2011;15 (6):R268 .
- Chung CK, Whitney R, Thomphson CM, et al. Experience with an Enteral-Based Nutritional Support Regimen in Critically-Ill Trauma Patients. J Am Coll Surg 2013;217 (6)1-18.
- Davies AR, Morrison SS, Bailey MJ, et al. A multicenter randomized controlled trial comparing early nasojejunal with nasograstric nutrition in critical illness. Crit Care Med 2012;40:2342-2348.
- McClave SA, Martindale RG, Vanek VW, et al. Guidelines for the Provision and Assessment of Nutrition Support Therapy in the Adult Critically Ill Patient: Society of Critical Care Medicine (SCCM) and American Society for Parenteral and Enteral Nutrition (A.S.P.E.N.). JPEN J Parenter Enteral Nutr. 2009 MayJun;33(3):277-316.
- National Heart, Lung, and Blood Institute Acute Respiratory Distress Syndrome (ARDS) Clinical Trials Network, Rice TW, Wheeler AP, Thompson BT, et al. Initial trophic vs full enteral feeding in patients with acute lung injury. JAMA 2012;307:795-803.
- Arabi YM, Aldawood AS, Haddad, SH, et al. Permissive Underfeeding or Standard Enteral Feeding in Critically Ill Adults. NEJM 2015;37:2398-408.
- Yaseen MA, Aldawood AS, Haddad SH, et al. Permissive underfeeding or standard enteral feeding in critically ill adults. N Engl J Med 2015;372:2398-408.
- Charles EJ, Petroze RT, Metzger R. Hypocaloric compared with eucaloric nutritional support and its effect on infection rates in a surgical intensive care unit: a randomized controlled trial. Am J Clin Nutr 2014;100:1337-43.
- Marik PE, Hooper MH. Normocaloric versus hypocaloric feeding on the outcomes of ICU patients: a systematic review and meta-analysis. Intensive Care Med. 2015 Nov 10. [Epub ahead of print].
- Labow BI, Souba WW. Glutamine-therapeutic usage and analysis of glutamine metabolism. World J Surg. 2000;24:1503-1513.
- Heyland D, Muscedere J, Wischmeyer PE, et al. A randomized trial of glutamine and antioxidants in critically ill patients. N Engl J Med 2013;368:1489-97.
- van Zanten AR, Sztark F, Kaisers UX, et al. High-protein enteral nutrition enriched with immune-modulating nutrients vs standard high-protein enteral nutrition and nosocomial infections in the ICU: A randomized clinical trial. JAMA 2014;312:514-524.
- van Zanten AR, Dhaliwal R, Garrel D, Heyland DK. Enteral glutamine supplementation in critically ill patients: a systematic review and meta-analysis. Crit Care 2015;19:294.
- Garrel D, Patenaude J, Nedelec B, et al: Decreased mortality and infectious morbidity in adult burn patients given enteral glutamine supplements: a prospective, controlled, randomized clinical trial. Crit Care Med 2003; 31:2444–2449
- Nathens A, Neff M, Jurkovich G, Klotz P, et al. Randomized, prospective trial of antioxidant supplementation in critically ill surgical patients. Ann Surg. 2002;236:814-822.
- Moore FA, Moore EE, Kudsk KA, et al. Clinical benefits of an immune-enhancing diet for early post-injury enteral feeding. J Trauma. 1994;37:607-615.
- Collier BR, Giladi A, Dossett LA, et al. Impact of high-dose antioxidants on outcomes in acutely injured patients. JPEN. 2008;32 (4):384-388.
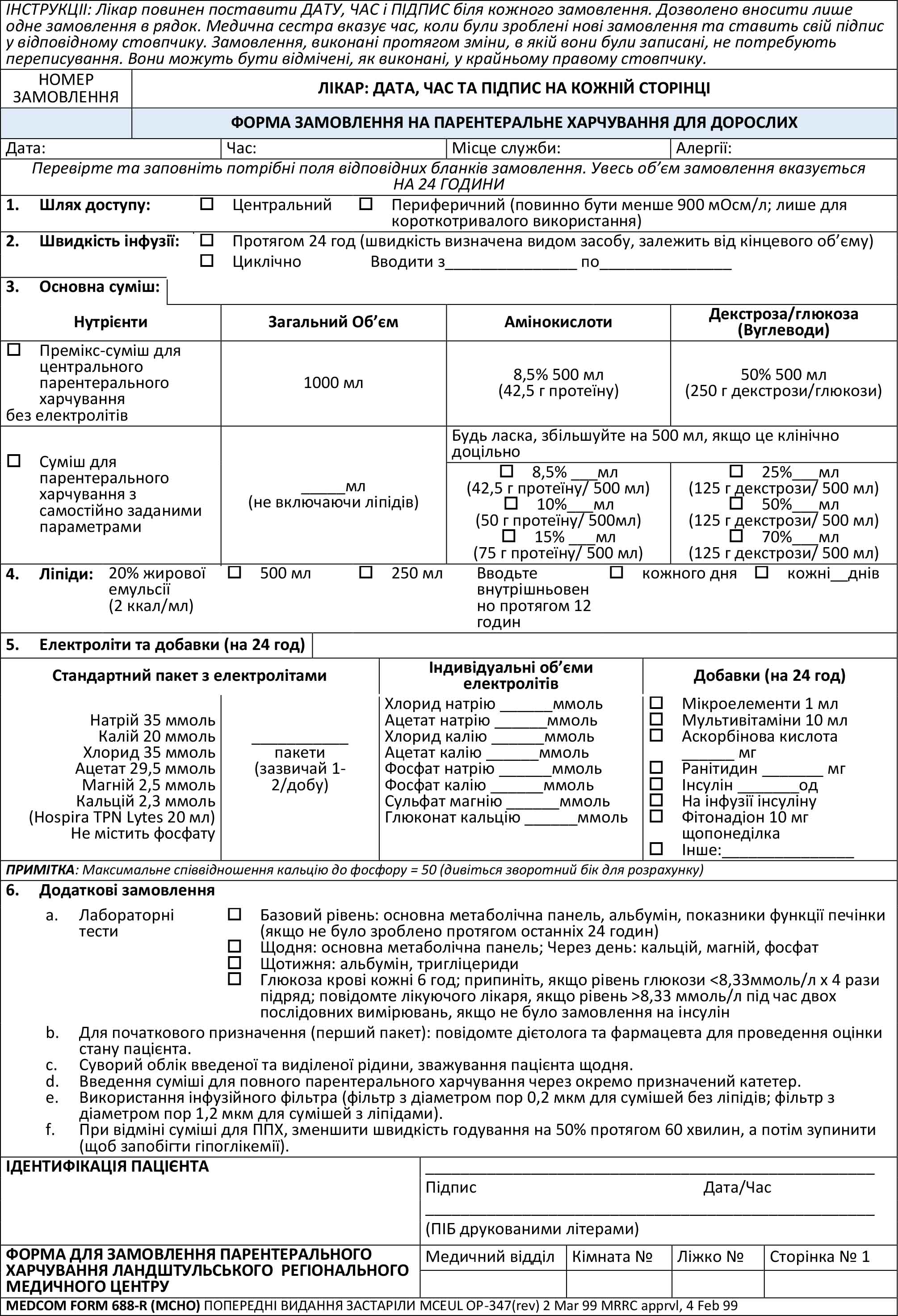
Додаток А: Форма замовлення на парентеральне харчування для дорослих
Додаток В: Короткий кишеньковий довідник з ентерального харчування
Вибір суміші
Суміші для ентерального харчування у пацієнтів, що потребують інтенсивної терапії
(З високим вмістом білків/концентровані, можуть містити імунонутрієнти)
- Пацієнти зі значною травмою отримують імунозміцнююче харчування протягом 10 днів (крім пацієнтів з ОПІКАМИ)
- Пацієнти без травм, які, на думку хірурга, мають ризик серйозних септичних захворювань, такі як:
- Пацієнти з помірним харчовим дефіцитом, яким проводяться великі планові оперативні втручання на стравоході, шлунку, підшлунковій залозі (з дванадцятипалою кишкою або без неї), органах гепатобіліарної системи або виконується черевно-промежинна резекція/екстирпація прямої кишки.
- Пацієнти з тяжким харчовим дефіцитом або ті, яким проводиться резекція товстого кишківника.
- Тривале голодування >5 днів
- Фістула дистального відділу товстого кишківника з великою кількістю виділень (High output fistula - більше 500 мл/день)
Елементні суміші
Пацієнти, які мають:
- Підтверджену непереносимість першої використаної суміші
- Стійка, важка діарея >48 годин
- Травма підшлункової залози або дванадцятипалої кишки
- Помірне здуття >24 год
- Синдром короткого кишківника
- На розсуд лікуючого лікаря.
Полімерна суміш
Пацієнти, які не відповідають критеріям імунозміцнюючої дієти, але мають нормальну травну та всмоктувальну здатність шлунково-кишкового тракту
Повне парентеральне харчування
Показання включають:
- Масивна резекція тонкої кишки, резистентна до ентерального харчування
- Фістула з великою кількістю виділень /High output fistula (високий вихід - більше 500 мл/день) після невдачі елементної дієти
- Неможливість задовольнити >60% потреб в калоріях ентерально на 5-й день перебування у ВІТ
Протокол годування
Після завершення ресусцитаційних заходів розпочніть введення повноцінної суміші зі швидкістю 20 мл/год наступним чином:
- Збільшуйте швидкість на 20 мл/год кожні 8 годин, поки не досягнете цільового значення.
- У пацієнтів з опіками/травмою голови без травми живота збільшуйте швидкість кожні 4 години, доки не буде досягнуто цільового значення.
- Не припиняйте ентеральне харчування для процедур, які передбачають транспортування до операційної, проведення комп’ютерної томографії або аеромедичної евакуації (якщо зонд введений дистальніше зв’язки Трейца).
Харчова потреба в енергії/білках
Ккал (загальні)
- 25-35 ккал/кг сухої ваги при стресі/травмі/опіках
- 20-25 ккал/кг сухої ваги для пацієнтів, що перебувають на штучній вентиляції легень
- 11-14 ккал/кг фактичної маси тіла або 22-25 ккал/кг ідеальної ваги при ожирінні (ІМТ > 30)
Білки
- 1,2-1,5 грам білків/кг
- 1,5-2,0 грам білків/кг при травмі голови або іншій травмі, або опіках
- 2 г/кг ідеальної ваги/добу для пацієнтів з ожирінням
Додаток С: Ведення пацієнта з непереносимістю ентерального харчування
| Ведення пацієнта з непереносимістю |
| Показник | Важкість | Визначення | Лікування |
| Блювання | (Поява) | Будь-яке | - При відсутності орогастрального зонда, встановіть його і розпочніть повільну інтермітуючу аспірацію
- Перевірте функціональність/локалізацію наявного орогастрального зонда
- Якщо орогастральний зонд встановлено коректно, зменшіть швидкість годування на 50% та подзвоніть лікуючому лікарю
|
| Здуття живота та/або спазми чи чутливість (якщо можна оцінити) | Легкий ступінь | Анамнез та/або фізикальний огляд | - Підтримуйте швидкість годування
|
| Помірний ступінь | Анамнез та/або фізикальний огляд | - Підтримуйте швидкість годування. Не збільшуйте обʼєм
- Виконайте рентгенографію нирок, сечоводів і сечового міхура в передньо-задній проекції в положенні на спині
- Огляньте на предмет непрохідності кишківника
- Якщо помірне здуття зберігається протягом > 24 год, переведіть пацієнта на елементну суміш
|
| Тяжкий ступінь | Анамнез та/або фізикальний огляд | - Припиніть годування через зонд
- Контролюйте рідинний баланс.
- Розгляньте призначення загального аналізу крові, визначення лактату, газів артеріальної крові, Chem7 (азот сечовини, CO2, креатинін, глюкоза, хлор, калій, натрій), КТ органів черевної порожнини.
- Перевірте тиск в сечовому міхурі
|
| Діарея | Легкий ступінь | 1-2 x /24 год або 200-400 мл/24 год | - Збільшіть швидкість годування за протоколом
|
| Помірний ступінь | 3-4 x / 24 год або 400-600 мл/24 год | - Підтримуйте швидкість годування. Не збільшуйте обʼєм
- Перевірте пацієнта на наявність інфекції Clostridium Difficile згідно з локальним лікарняним протоколом
- Розгляньте призначення розчинної клітковини (Nutrisource Fiber ®, 1 упаковка 2 рази на добу, збільшуйте до 1 упаковки 4 рази на добу).
- Розгляньте необхідність прийому призначення пробіотиків за відсутності протипоказань
|
| Тяжкий ступінь | >4 x / 24 год або >600 мл / 24 год | - Знизьте швидкість годування на 50%
- Перегляньте медичні записи: антибіотики, медикаменти для профілактики закрепів, прокінетики, інші
- Перевірте пацієнта на наявність інфекції Clostridium Difficile згідно з локальним лікарняним протоколом
- Якщо пацієнт позитивний щодо Clostridium Difficile, розпочніть відповідне лікування та відмініть протидіарейні засоби на 48 год.
- Якщо пацієнт негативний щодо Clostridium Difficile, давайте 2 мг лопераміду після кожного рідкого випорожнення
- Призначте рентгенографію нирок, сечоводів і сечового міхура в передньо-задній проекції в положенні на спині для визначення локалізації зонда
- Розгляньте необхідність переходу на елементну суміш
- Контролюйте рівень рідини та електролітів
|
| Велика кількість аспірату з назогастрального зонда | вимірюється | >1200 мл / 12 год | - Припиніть годування через зонд
- Призначте рентгенографію органів черевної порожнини для визначення положення орогастрального та назоєюнального зондів.
- Якщо зонд опустився дистальніше пілоруса, відтягніть його назад у шлунок і відновіть годування через зонд з попередньою швидкістю.
- Якщо назоєюнальний зонд знаходиться в шлунку, проконсультуйтеся з гастроентерологом щодо корекції його положення
- Якщо обидва зонди знаходяться в правильному положенні, зменшіть швидкість годування на 50%, проведіть повний огляд пацієнта
- Проаналізуйте аспірат з орогастрального зонда на наявність глюкози
- Якщо глюкоза >6,11 ммоль/л, припиніть годування через зонд і повторіть аналіз через 12 годин.
- Якщо аналіз на глюкозу негативний, відновіть годування через зонд із швидкістю, наполовину меншою за попередню.
|
| Особливості щодо медикаментів | Інотропні засоби (наприклад, добутамін, мілринон) | - Збільшуйте обʼєм згідно з протоколом
|
| Міорелаксанти і вазоактивні засоби: будь-які тривалі інфузії міорелаксантів, вазопресину >0,04 од/хв, дофамін >10 мкг/кг/хв, норадреналін >5 мкг/хв, фенілефрин >50 мкг/хв, будь-який адреналін | - Елементна суміш зі швидкістю 20 мл/год. Не збільшуйте швидкість
- Відмініть модулярні білки (Beneprotein/Prostat).
- Розгляньте необхідність одночасного старту повного парентерального харчування, починаючи з 7 дня перебування у ВІТ.
|
Додаток D: Інформація щодо не передбаченого інструкцією застосування лікарських засобів у Настановах з клінічної практики
Мета
Мета цього Додатка — надати роз’яснення політики та практики Міністерства оборони США щодо включення в Настанови з клінічної практики «незатверджених» показів для продуктів, які були схвалені Управлінням з контролю якості продуктів харчування і лікарських засобів США (FDA). Це стосується використання препаратів не за призначенням для пацієнтів, які належать до Збройних сил США.
Вихідна інформація
Незатверджене (тобто «не за призначенням» - “off-label”) використання продуктів, схвалених FDA, надзвичайно поширене в медицині США і зазвичай не регулюється окремими нормативними актами. Проте, згідно з Федеральним законодавством, за деяких обставин застосування схвалених лікарських засобів за незатвердженими показами регулюється положеннями FDA про «досліджувані нові ліки». До цих обставин належить використання в рамках клінічних досліджень, а також, у військовому контексті, використання за незатвердженими показами згідно з вимогами командування. Деякі види використання за незатвердженими показами також можуть підлягати окремим нормативним актам.
Додаткова інформація щодо застосування за незатвердженими показами у Настановах з клінічної практики
Включення до Настанов з клінічної практики використання медикаментів за незатвердженими показами не належить до клінічних випробувань і не є вимогою командування. Більше того, таке включення не передбачає, що Військова система охорони здоров’я вимагає від медичних працівників, які працюють в структурах Міноборони США, застосовувати відповідні продукти за незатвердженими показами або вважає це «стандартом медичної допомоги». Швидше, включення до CPGs використання засобів «не за призначенням» має поглиблювати клінічне судження відповідального медичного працівника шляхом надання інформації щодо потенційних ризиків та переваг альтернативного лікування. Рішення приймається на основі клінічного судження відповідальним медичним працівником у контексті відносин між лікарем і пацієнтом.
Додаткові процедури
Виважений розгляд
Відповідно до цієї мети, в обговореннях використання медикаментів «не за призначенням» в CPG конкретно зазначено, що це використання, яке не схвалено FDA. Крім того, такі обговорення є збалансованими у представленні даних клінічних досліджень, включаючи будь-які дані, які свідчать про обережність у використанні продукту, і, зокрема, включаючи усі попередження, видані FDA.
Моніторинг забезпечення якості
Що стосується використання «не за призначенням», діяльність Міністерства оборони США полягає у підтримці регулярної системи моніторингу забезпечення якості результатів і відомих потенційних побічних ефектів. З цієї причини підкреслюється важливість ведення точних клінічних записів.
Інформація для пацієнтів
Належна клінічна практика передбачає надання відповідної інформації пацієнтам. У кожних Настановах з клінічної практики, де йдеться про використання засобу «не за призначенням», розглядається питання інформування пацієнтів. За умови практичної доцільності, слід розглянути можливість включення додатка з інформаційним листком для пацієнтів, що видаватиметься до або після застосування продукту. Інформаційний листок має в доступній для пацієнтів формі повідомляти наступне: a) що дане застосування не схвалене FDA; b) причини, чому медичний працівник Міністерства оборони США може прийняти рішення використати продукт з цією метою; c) потенційні ризики, пов’язані з таким застосуванням.























