Стислий огляд надання допомоги
- Біль є універсальним симптомом при бойових пораненнях і обов’язковим об’єктом надання допомоги при травмі.
- Належне знеболення є надзвичайно важливою складовою надання допомоги від місця отримання поранення до поступлення в медичний заклад найвищого рівня; доведено, що адекватне знеболення запобігає розвитку синдрому хронічного болю та зменшує частоту посттравматичного стресового розладу.
- Перш ніж підвищувати дозу знеболювальних, розгляньте інші потенційні фізіологічні причини.
- Алгоритми щодо лікування болю і тривоги мають орієнтуватися на чітко визначені цілі; при цьому слід використовувати мінімальну дозу ліків, необхідну для досягнення цих цілей.
- Починаючи із закладів III рівня слід створювати бригади з лікування гострого болю (Acute Pain Service, APS), що мають бути невід’ємною складовою надання допомоги пораненим.
- Основне завдання бригади APS — забезпечувати ефективне знеболення, а також лікування і профілактику тривоги й делірію у поранених. Як основу оцінки та орієнтир при лікуванні слід використовувати стандартизовані й валідовані оціночні шкали (див. додатки).
- Бригада APS повинна вести систему відстеження із переліком усіх пацієнтів під опікою бригади з лікування гострого болю, із зазначенням травм і терапевтичних втручань разом із коментарями щодо плану лікування.
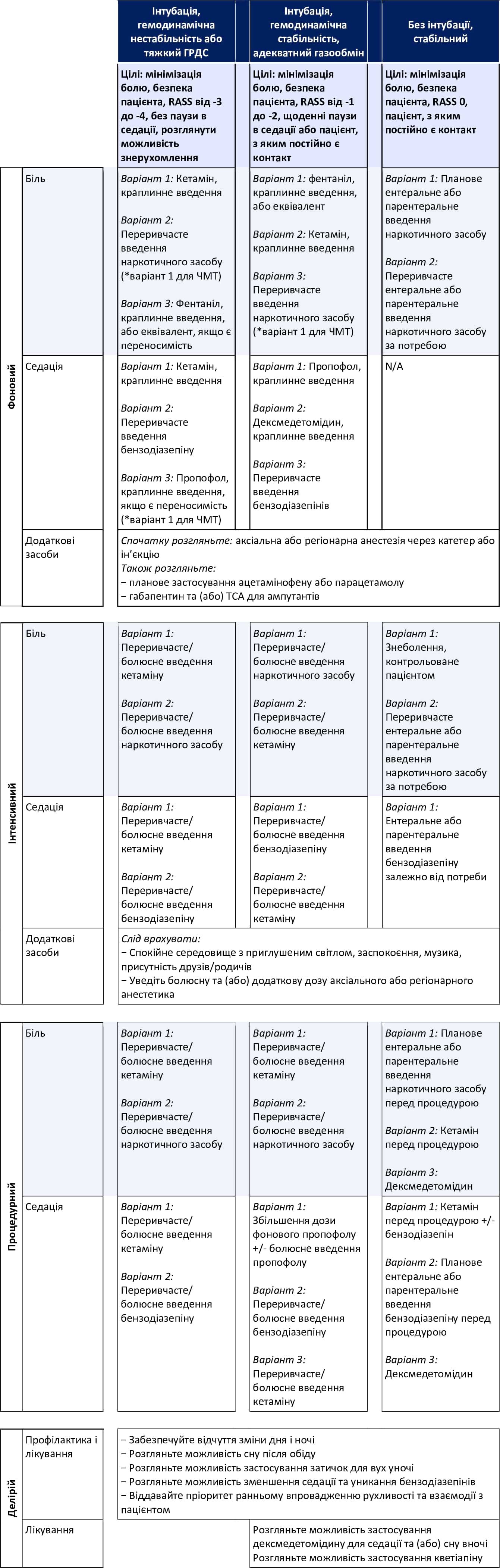
- Загальні рекомендації щодо медикаментозного лікування болю, тривоги та делірію наведено в Таблиці 1 в Додатку A.
- Додаток H містить зразок медичних алгоритмів, включно з можливими лікарськими засобами та дозами.
- Переривчасте застосування анальгетиків та анксіолітиків слід розпочати перед безперервним застосуванням; також щодня слід відключати постійні крапельниці, щоб виконати достовірне фізикальне обстеження та спробу спонтанного дихання у пацієнтів на штучній вентиляції легень, які є потенційними кандидатами на екстубацію.
- У поранених із травмами, що роблять їх схильними до компартмент-синдрому, слід ретельно обміркувати рішення про використання регіонарної анестезії, якщо пацієнтам раніше не виконували фасціотомію. Слід виконувати ретельне спостереження за регіонарною анестезією, щоб не пропустити компартмент-синдром.
Цілі
Ці настанови містять емпіричні рамкові рекомендації щодо лікування болю, ажитації/тривоги та делірію у поранених в умовах бойових дій. Надання найсучаснішого лікування болю у поранених в умовах бойових дій є моральним, медичним та оперативним імперативом, що дозволяє зменшити частоту синдрому хронічного болю, ПСТP і тривалої залежності від наркотичних знеболювальних. Цей процес починається у місці отримання поранення та в закладі I рівня. При переміщенні пораненого на кожний наступний рівень надання допомоги слід постійно забезпечувати лікування болю і тривоги, враховуючи зростання можливостей військових медичних закладів. Ці настанови основну увагу приділяють закладам III рівня, оскільки це перший заклад, оснащення якого дозволяє забезпечити належне лікування у різних формах. Забезпечення оптимального знеболення вимагає командної роботи; координувати ці зусилля повинні хірург-травматолог, консультант бригади з лікування гострого болю та консультант із інтенсивної терапії спільно з медсестрою, яка в кінцевому підсумку виконує призначене лікування та стежить за його відповідністю. Ці настанови розглядають потребу створення бригади з лікування гострого болю у закладах III рівня.1-3 Бригада з лікування гострого болю розглядається як обов’язковий додаток до травматологічної бригади. У рамках такої міждисциплінарної співпраці визначатимуться потреби в знеболенні в закладах III рівня на основі складності травми, тягаря травми, ризиків коагулопатії / тромбоемболічних явищ, очікуваної кількості хірургічних процедур, плану евакуації, логістичних обмежень та досвіду лікаря. Важливо також визнати, що знеболення має пріоритет над седацією, і що принцип «анальгоседації» (тобто седації на основі знеболення) є життєздатним рішенням для поранених у критичному стані.4 Ці настанови також містять конкретні рекомендації щодо лікування окремо для закладів I, II і III рівня і вище. Настанови для закладів I рівня взято з рекомендацій Комітету з надання допомоги пораненим в умовах бойових дій Міністерства оборони.
Вихідна інформація
Біль є універсальним симптомом при бойових пораненнях. Забезпечення лікування болю, тривоги і делірію у поранених в критичному стані має першочергове значення не тільки в умовах гострої травми, але й для запобігання довгостроковим наслідкам, що можуть виникнути, якщо не буде надано належну допомогу. Активний контроль болю, тривоги і делірію, що включає профілактику, оцінку і лікування, є медичним і моральним імперативом починаючи від місця отримання поранення (надання допомоги пораненим в умовах бойових дій) і на всіх подальших рівнях медичних закладів. Враховуючи істотний тягар травми у пацієнтів із бойовими пораненнями, пріоритетні хірургічні втручання та заходи із порятунку життя можуть визначатися як першочергові, применшувати важливість оцінки й активного лікування болю, тривоги й делірію або вступати в суперечність з таким лікуванням. Усвідомлюючи, що обґрунтована клінічна оцінка, логістичні та кадрові обмеження, а також оперативне середовище можуть вимагати застосування інших методів, слід розробити відповідні настанови. Належне знеболення на ранньому етапі з метою зменшення ступеня тяжкості посттравматичного стресового розладу, а також постійний контроль болю є обов’язковим компонентом надання допомоги при травмі. Реакція на стрес передбачає добре визначену послідовність фізіологічних і молекулярних явищ, які включають лихоманку, тахікардію, тахіпное, гіпертензію, шлунково-кишкову непрохідність, гіперкоагуляцію, катаболізм білка, імуносупресію; це лише деякі з-поміж небажаних наслідків, які затримують або перешкоджають повній реабілітації та одужанню пораненого воїна.5,6 Ефективне лікування болю вимагає координації зусиль усіх медичних працівників, починаючи від місця отримання поранення і на всіх рівнях надання допомоги та системи медичної евакуації.
У пацієнтів із критичними травмами біль часто супроводжується тривогою і делірієм, тоді як лікарські засоби, призначені для лікування цих станів, парадоксальним чином можуть збільшити їхню тривалість або навіть погіршити їх. Мультимодальний підхід до контролю болю може зменшити загальну дозу та тривалість застосування наркотичних засобів, мінімізувати або навіть усунути ускладнення, пов’язані з наркотичними засобами, а також зменшити наркотичну залежність.7 Додаткові засоби, такі як ацетамінофен, кетамін, нестероїдні протизапальні препарати (НПЗП), безперервні інфузії для блокади периферичних нервів і безперервні епідуральні інфузії значно підвищують безпеку пацієнтів і ефективність наркотичних засобів, одночасно зменшуючи побічні ефекти.
Командний мультимодальний підхід
- Впровадження командного мультимодального підходу до лікування болю, тривоги і делірію фактично починається у закладах III рівня, і його слід продовжувати у закладах наступних рівнів. Такий мультимодальний підхід передбачає створення бригади з лікування гострого болю починаючи із закладів III рівня та упродовж усього лікування пораненого. Керівником бригади слід призначити лікаря, який володіє найбільшим досвідом лікування болю. У закладах III рівня до складу бригади входять наявні працівники польового шпиталю: лікар (зазвичай анестезіолог) як консультант щодо болю, головна медсестра бригади, а також медсестри відділення, відповідальні за лікування болю.1,8,9
- Бригада з лікування гострого болю має часто і безпосередньо спілкуватися з основною бригадою, керівником якої зазвичай є хірург-травматолог та (або) реаніматолог. Найкраще це забезпечити шляхом включення бригади з лікування гострого болю у щоденні обходи під керівництвом основної травматологічної бригади та включення оцінки та плану лікування болю як обов’язкового компонента обходів пацієнтів. Якщо бригаду з лікування гострого болю неможливо включити в обходи, бригада сама відповідатиме за щоденні обходи щодо лікування болю, консультації щодо контролю болю та звітування керівнику травматологічної бригади.
- Бригада з лікування гострого болю має бути доступною для всіх пацієнтів, які поступають у заклад III рівня в театрі бойових дій. Основне завдання бригади APS — забезпечувати ефективне знеболення, а також лікування і профілактику тривоги й делірію у поранених. Для оцінки болю, тривоги та делірію розроблено стандартизовані й валідовані оціночні шкали, в тому числі:
- Шкала оцінки болю Міноборони і Міністерства у справах ветеранів США (Додаток B і Додаток C)
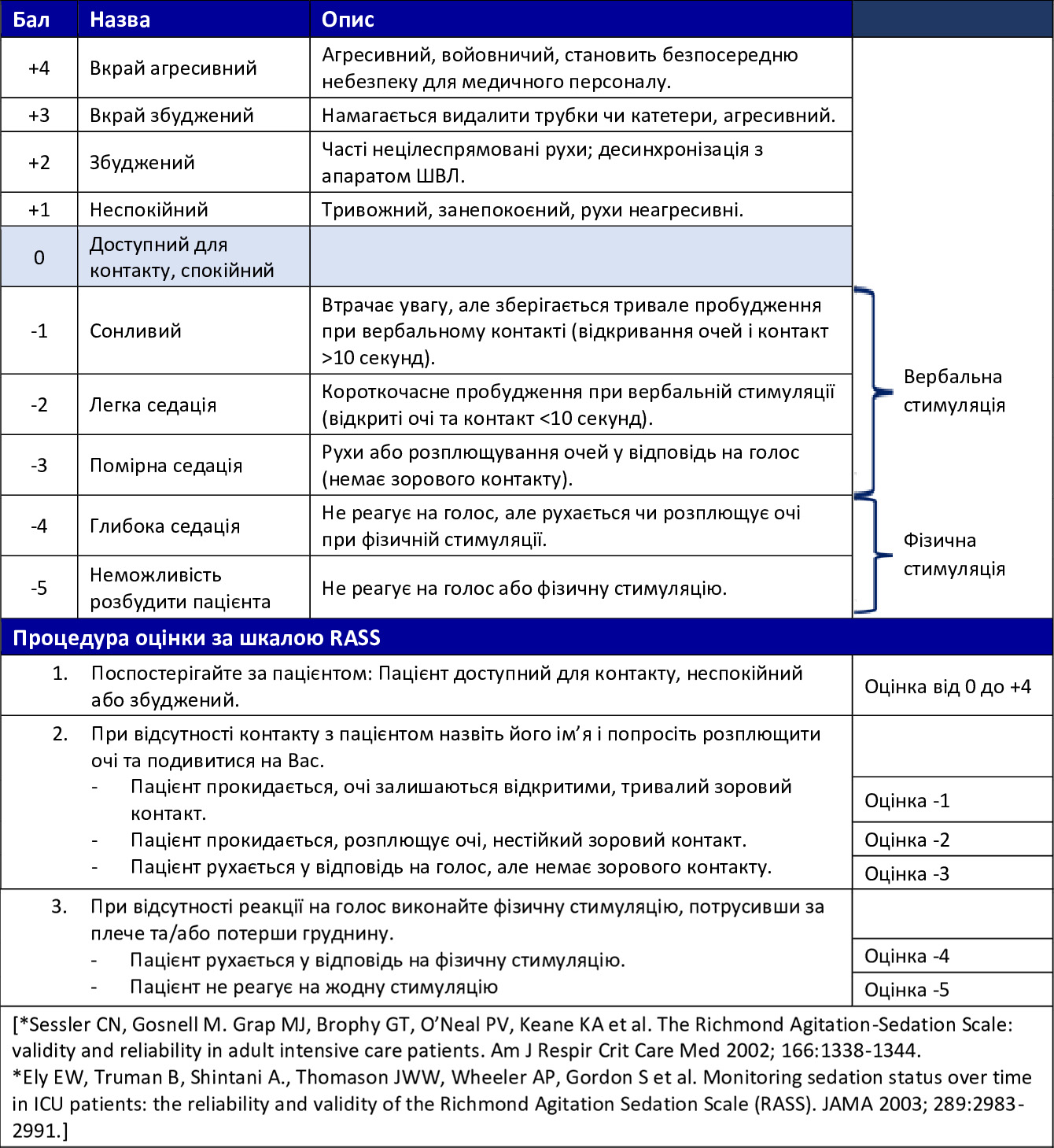
- Річмондська шкала ажитації — седації (RASS) (Додаток D)
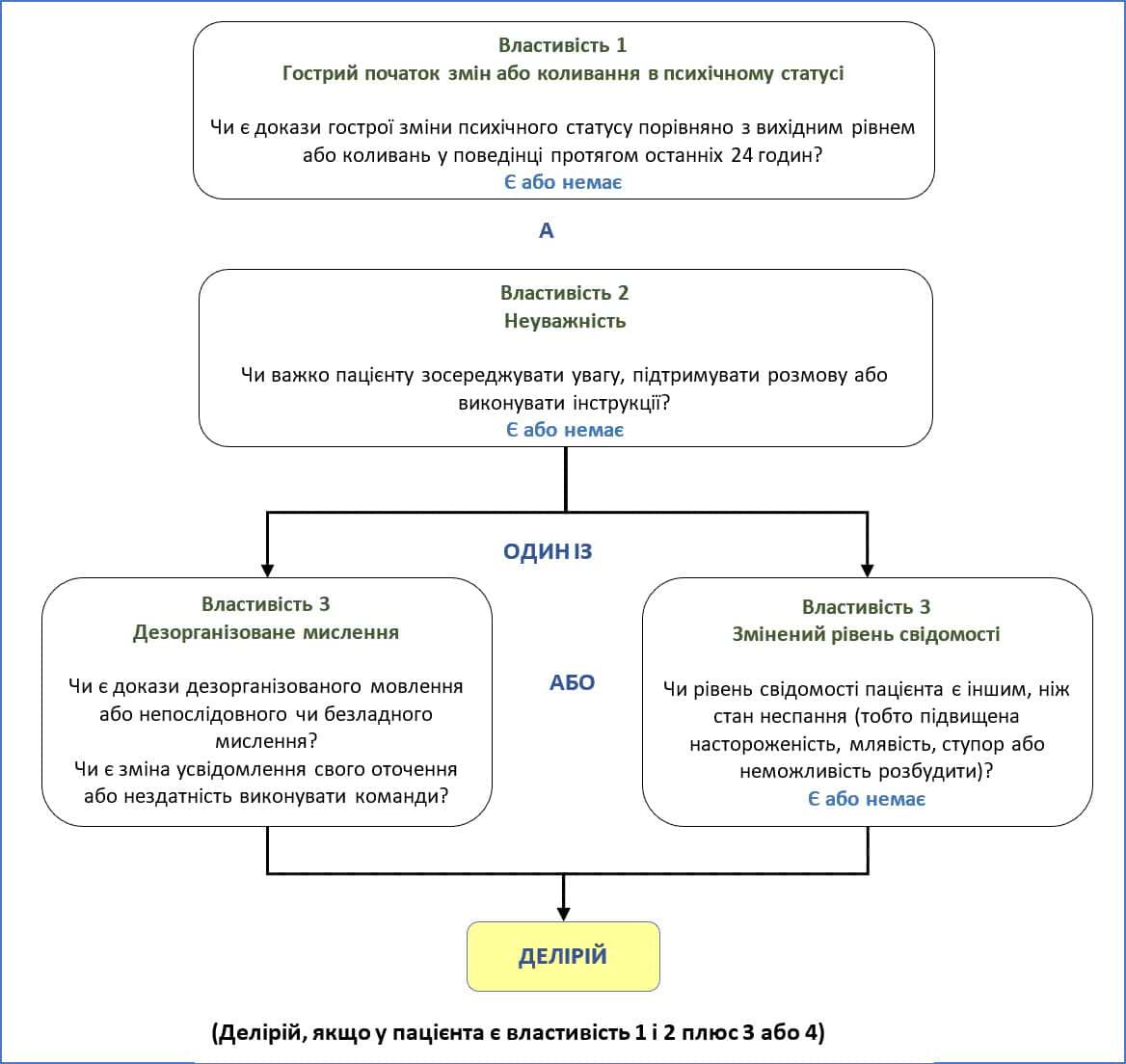
- Метод оцінки сплутаності свідомості (CAM) (Додаток E)
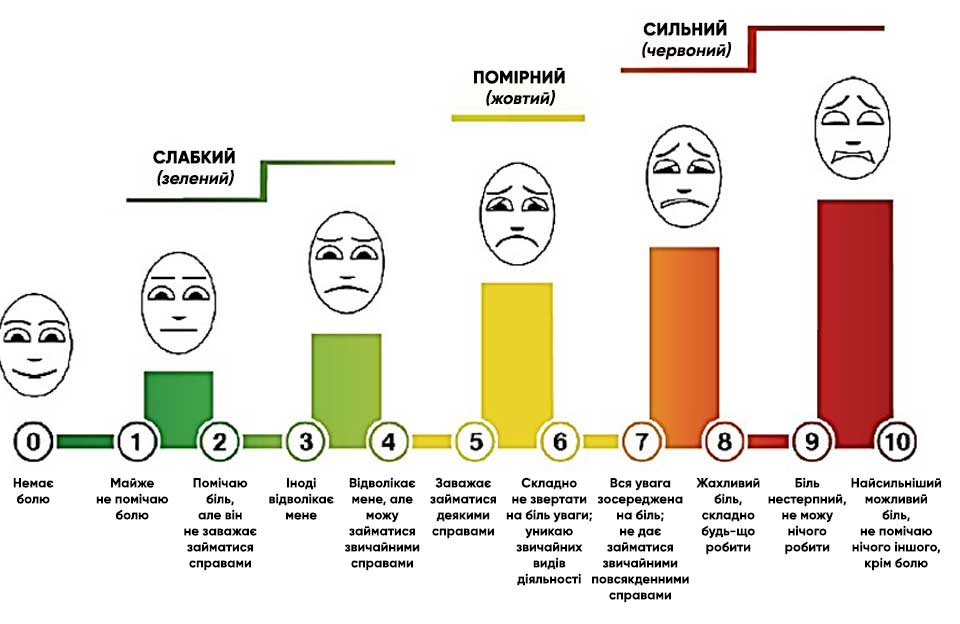
- Шкала оцінки болю Міноборони і Міністерства у справах ветеранів США (DVPRS) і додаткові запитання проходили і надалі проходять валідаційні дослідження.10 Шкалу DVPRS слід використовувати для оцінки болю, шкалу RASS — для оцінки тривоги, а шкалу CAM — для оцінки наявності делірію. Перш ніж розпочинати лікування, розгляньте потенційні хірургічні і медичні причини погіршення болю і тривоги.
- Бригада з лікування гострого болю має складатися із міждисциплінарного колективу лікарів, середнього медичного персоналу і фармацевтів та бути доступною цілодобово без вихідних. На додаток до участі в щоденних обходах, вони мають відповідати за координацію планів з лікування болю із головним льотним хірургом, бригадою аеромедичної евакуації та медичним закладом, який приймає поранених. Крім того, слід упровадити систему відстеження і покращення показників (ПП), що включає всіх пацієнтів під опікою бригади із переліченням їхніх поранень, терапевтичних втручань і плану лікування; електронну версію системи слід вести на всіх рівнях надання допомоги.
- З метою полегшення роботи бригади з лікування гострого болю слід тримати напоготові візок з усіма необхідними витратними матеріалами для регіонарної анестезії. У виділеному приміщенні для введення регіонарної анестезії має бути безпосередній доступ до лікарських засобів для розширеної серцево-легеневої реанімації (Advanced Cardiovascular Life Support, ACLS) та препарату Інтраліпід. Щоб полегшити виконання регіонарної блокади, бригада з лікування гострого болю і анестезіологічна бригада повинні мати можливість використання апарату УЗД. Можна використовувати медичні алгоритми бригади з лікування гострого болю, що мають передбачати знеболення з використанням мінімальної кількості лікарських засобів, необхідних для забезпечення комфорту пацієнта. Метою для пацієнтів з делірієм є досягнення стану без делірію, що визначається на основі шкали CAM.
- Додаток H містить зразок медичних алгоритмів, включно з можливими лікарськими засобами та дозами.
- Підсумковий перелік рекомендацій наведено в Таблиці 1 в Додатку A.
Профілактика
Біль
Запобігти болю внаслідок травми неможливо, проте є чимало механізмів для мінімізації та контролю болю. Всі заходи починаються з припинення дії механізму травми та лікування травми, що не розглядається в цих настановах; однак важливою частиною тривалого контролю болю є раннє та адекватне втручання в місці отримання поранення.1,11-13 Розпізнавання та оцінка болю має бути стандартною частиною лікування поранених в умовах бойових дій із подальшим своєчасним втручанням. Раннє втручання має важливе значення для запобігання психологічним і біохімічним наслідкам болю та пов’язаних із болем явищ, а також для зниження ризику синдрому хронічного болю.4 Алгоритми лікування болю і тривоги мають включати визначені цілі, для досягнення яких слід використовувати мінімальну кількість лікарських засобів. Орієнтиром для визначення таких цілей є забезпечення комфорту і безпеки пацієнта.
Тривога і делірій
Схожим чином, профілактика тривоги, ажитації і делірію починається з їх розпізнавання. Ризик виникнення тривоги є у всіх поранених військовослужбовців, і вони можуть намагатися приховати або не показувати тривогу. Як і у випадку профілактики болю, до основних принципів належить контроль першопричин, у тому числі болю, гіпоксії, метаболічних розладів і впливу лікарських засобів. Розвитку болю, тривоги й делірію сприяє дезорієнтація в часі і просторі внаслідок втрати свідомості, седації і нечіткого усвідомлення свого оточення під час госпіталізації. Цьому можна запобігти завдяки частим і системним заходам із відновлення орієнтації та підтримки нормального режиму сну.4
Для підтримки здорової фази швидкого сну рекомендується включати яскраве світло або забезпечувати доступ сонячного світла протягом дня і виконувати примусове затемнення в нічні години. Алгоритми мають передбачати плановий період з мінімальними порушеннями або без них протягом стандартних годин сну, а також використання пацієнтами затичок для вух під час сну для мінімізації впливу шуму. І навпаки, за потреби пацієнтам слід надавати слухові апарати або окуляри, щоб забезпечити можливість належного використання органів чуття (запобігти сенсорній депривації). У поранених, які пережили вибух на близькій відстані, слід припускати певний ступінь втрати слуху, тому їм слід виконати аудіологічне обстеження. Переривчасте застосування анальгетиків та анксіолітиків слід розпочати перед безперервним застосуванням. Пацієнтів, яким необхідно вводити препарати частіше ніж кожні 2 години, слід перевести на безперервне введення із титруванням дози до досягнення цільового показника.
Профілактика делірію у пацієнтів із критичними пораненнями включає координоване пробудження і самостійне дихання (Awakening and Breathing Coordination, ABC), нефармакологічні втручання щодо делірію (Delirium, D), а також раннє впровадження вправ (Exercise, E) і рухливості. Алгоритм ABCDE слід впроваджувати в плани лікування всіх пацієнтів відділень інтенсивної терапії не пізніше, ніж у закладах III рівня.4,14 У пацієнтів із гострою ажитацією для короткострокової седації можна використовувати пропофол. Він швидко починає діяти і так само швидко виводиться. Пропофол пов’язують із гіпотензією, що може бути викликана виснаженням внутрішньосудинного об’єму. Його розчиняють у 10% ліпідному розчині, що слід враховувати при обчисленні потреб у калоріях. Пропофол є відмінним препаратом для пацієнтів у відділенні інтенсивної терапії, для яких заплановано аеромедичну евакуацію. При транспортуванні пропофол слід вводити лише інтубованим пацієнтам.
Спроби спонтанного дихання (Spontaneous Breathing Trials, SBT) слід виконувати щоденно. Фізичну терапію та ерготерапію слід розпочинати якомога швидше або принаймні через 72 години після інтубації.14,15
З огляду на брак достатніх доказів того, що профілактичне застосування антипсихотичних засобів у відділенні загальної інтенсивної терапії запобігає делірію, ми не надаємо жодних рекомендацій щодо цього.16 Хоча бензодіазепіни потенційно є корисними для контролю ажитації, вони можуть посилити делірій, тому їх слід уникати або звести до мінімуму у пацієнтів із делірієм або підвищеним ризиком його виникнення.
Оцінка болю
Певний ступінь болю спостерігається при всіх бойових пораненнях. Хоча через інтенсивність ситуації реальний ступінь болю спочатку може бути прихований, бойовий медик повинен оцінити рівень болю; таку оцінку також можна виконати після прибуття пацієнта в заклад I рівня. Оцінку наявності болю у неінтубованих пацієнтів із тяжкими пораненнями слід виконувати кожні 1–4 години. Слід постійно контролювати знеболення у всіх інтубованих пацієнтів. Ознаки недостатнього знеболення в інтубованих пацієнтів включають тахікардію, гіпертензію та ажитацію. При цьому слід обов’язково виключити інші причини, такі як ранній компартмент-синдром, невиявлені поранення або швидке погіршення фізіологічного стану. Для оцінки болю і відповідних тенденцій можна використати шкалу DVPRS разом з додатковими запитаннями, якщо з пацієнтом можна встановити відповідний контакт.3,10 Ступінь болю слід визначати у всіх пацієнтів після прибуття в заклад III рівня, а також під час їхнього перебування у відділенні інтенсивної терапії.
Оцінка ажитації і делірію
Черепно-мозкова травма (ЧМТ) може ускладнити оцінку тривоги, ажитації, делірію та болю. На додаток до загального тягаря травми, ЧМТ і терапевтичні втручання можуть впливати на оцінку ажитації, а також перешкоджати ретельному неврологічному обстеженню. Особливо високий ризик виникнення нетипових та (або) парадоксальних реакцій як на седативні засоби, так і на стимулянти спостерігається у пацієнтів із ЧМТ від помірного до тяжкого ступеня.17,18 Крім того, реакції на окремі лікарські засоби та їхній загальний вплив на пацієнта з ЧМТ з точки зору болю, перебування у свідомості, ажитації, тривоги та делірію можуть різко змінюватися протягом відносно короткого періоду разом зі змінами в перебігу поранення та когнітивному статусі. Нижче перелічено інструменти для оцінки болю. Річмондська шкала ажитації — седації (RASS) та Метод оцінки сплутаності свідомості (CAM); обидві шкали наведено в Додатку D і Додатку E.
Лікування болю: Загальна інформація
Як уже згадувалося, біль є універсальним симптомом при бойових пораненнях, що вимагає раннього та ефективного лікування. Доведено, що належне знеболення на ранньому етапі дозволяє зменшити ступінь тяжкості посттравматичного розладу, тоді як постійний контроль болю є обов’язковим компонентом надання допомоги при травмі. Неналежне лікування призводить до небажаних наслідків, які затримують або перешкоджають повній реабілітації та одужанню пораненого воїна.
Немедикаментозні методи лікування болю слід розглядати як терапію першої лінії, якщо біль є слабким або помірним, або як допоміжний засіб до опіоїдних препаратів. До цих методів належить акупунктура на полі бою (Battlefield Acupuncture, BFA), якщо її виконує лікар з відповідною підготовкою, і якщо є необхідні витратні матеріали. (Див. Додаток F.)
Що стосується конкретних опіоїдних препаратів, для досягнення бажаного контролю болю можна титрувати будь-який доступний опіоїд, доки не буде забезпечено рівноцінну ефективність. Ці настанови CPG основну увагу приділяють застосуванню кетаміну на всіх етапах надання допомоги в театрі бойових дій. Кетамін є надзвичайно ефективним анальгетиком як окремо, так і як допоміжний засіб до опіоїдів, і його можна використовувати для зменшення загального наркотичного навантаження.19,20 Доведено, що кетамін у парентеральних дозах 0,15–0,3 мг/кг зменшує показники болю, сукупну дозу застосованих наркотичних засобів і потребу в препаратах екстреної терапії при застосуванні в комбінації з морфіном для контролю гострого болю.20
Лікування болю у закладах I рівня
Настанови щодо лікування болю для закладів I рівня взято безпосередньо з рекомендацій Комітету з надання допомоги пораненим в умовах бойових дій Міністерства оборони (Tactical Combat Casualty Care, TCCC), доступних на вебсайті Deployed Medicine. Найновіші настанови із повним комплектом навчальних матеріалів і супровідною документацією представлені на вебсторінці системи військової охорони здоров’я через карту спільного доступу (https://mhs.health.mil/References/REF_TCCC.cshtml).
Крім того, науковий журнал Journal of the Special Operations Medical Association надає безкоштовний доступ до чинних протоколів (https://www.jsomonline.org/TCCC.html).21,22 Додаток H містить зразок медичних алгоритмів, включно з можливими лікарськими засобами та дозами.
Знеболення на полі бою, як правило, має здійснюватися з використанням одного з трьох методів згідно з протоколом потрійного знеболення TCCC. Тут представлено скорочену версію цього протоколу. Детальний опис можна отримати на вказаних вище вебсайтах.
- Метод 1 для болю від легкого до помірного ступеня, коли поранений все ще здатний виконувати бойове завдання, має включати таблетки ацетамінофену і мелоксикаму з тактичної аптечки TCCC, які приймаються одночасно.
- Метод 2 для болю від помірного до тяжкого ступеня, коли поранений не перебуває в стані шоку і не має дихальної недостатності, і коли ризик виникнення будь-якого із вказаних станів є неістотним, має включати пероральний трансмукозальний фентанілу цитрат (OTFC) 800 мкг. При застосуванні опіоїдних анальгетиків має бути доступним налоксон (0,4 мг в/в або в/м).
- Метод 3 для болю від помірного до тяжкого ступеня, коли поранений перебуває в стані геморагічного шоку або дихальної недостатності, або коли ризик виникнення будь-якого із вказаних станів є істотним, має включати кетамін 50 мг в/м чи і/н або кетамін 20 мг шляхом повільної в/в або в/к інфузії. Кетамін можна застосовувати кожні 30 хвилин при в/м чи і/н введенні або кожні 20 хвилин при в/в чи в/к введенні.
Поранених слід роззброїти після застосування перорального трансмукозального фентанілу цитрату (OTFC), а також обов’язково після застосування кетаміну. До і після застосування опіоїдів або кетаміну слід виконати обстеження психічного статусу за допомогою методу AVPU (alert, verbal, pain, and unresponsive — у свідомості, мовлення, біль, немає контакту) і задокументувати результати на карті TCCC (Форма DD 1380, червень 2014 р.). Кетамін може бути корисним допоміжним засобом для зменшення кількості опіоїдів, необхідних для ефективного полегшення болю. Кетамін безпечно застосовувати у поранених, які раніше отримували морфін або OTFC. В/в кетамін слід вводити протягом 1 хвилини.
Лікування болю у закладах II рівня
Хірургічне лікування з контролем пошкоджень виконується в закладах II рівня. До складу хірургічної бригади має входити анестезіолог та (або) сертифікована медична сестра-анестезіолог, які відповідають за периопераційний контроль болю. Заклади II рівня відрізняються своїм матеріально-технічним забезпеченням: операційна і відділення інтенсивної терапії у деяких з них розраховані лише на одного пацієнта, тоді як інші мають додаткові можливості для надання невідкладної допомоги та післяопераційного догляду.
У закладах II рівня з більш обмеженими можливостями біль слід контролювати за допомогою внутрішньовенного введення опіоїдів і титрування кетаміну залежно від потреби для забезпечення належного знеболення; якщо при застосуванні кетаміну виникають симптоми дисфорії, слід ввести невелику кількість бензодіазепіну.
У закладах II рівня з кращим забезпеченням є додатковий персонал, обладнання і витратні матеріали. У таких закладах може бути можливість виконувати блокаду периферичних нервів анестезіологом або хірургом-ортопедом, призначеним до підрозділу. Також можуть бути доступними інфузійні помпи для безперервної інфузії опіоїдів пацієнтам із тяжкими травмами, із титруванням дози залежно від потреби для забезпечення належного знеболення. У відділенні інтенсивної терапії за пацієнтами, яким виконуються інфузії, слід здійснювати ретельний моніторинг. Деякі із краще забезпечених закладів II рівня із розширеними палатами можуть мати помпи для знеболення, контрольованого пацієнтом (Patient Controlled Analgesia, PCA), що пацієнти можуть використовувати для полегшення болю. Перед початком застосування помпи PCA слід забезпечити належний контроль болю; після цього пацієнт може використовувати помпу PCA для самостійного введення знеболювальних залежно від потреби. Нижче наведено початкові дози для помпи PCA.
- Доза морфіну для помпи PCA у дорослих становить 1–3 мг із блокуванням на 10–20 хвилин.
- Доза гідроморфону для помпи PCA у дорослих становить 0,1–3 мг із блокуванням на 10–20 хвилин.
- Доза фентанілу для помпи PCA становить 15–25 мкг із блокуванням на 10–20 хвилин.
Середній медичний персонал повинен здійснювати моніторинг за пацієнтами, які використовують помпу PCA. Для лікування дихальної недостатності, що може виникнути внаслідок застосування опіоїдів, слід забезпечити наявність налоксону.
Лікування болю у закладах III рівня
Регіонарну анестезію слід виконувати в умовах, де можливо забезпечити спостереження, і де є середній медичний персонал, який може допомогти з доглядом за пацієнтами та забезпечити належні заходи з реабілітації пацієнтів. Бригада з лікування гострого болю (детально розглянута вище) відповідає за підготовку та постійне оновлення регламенту дій, що має включати вказані нижче аспекти.
- Безперервна епідуральна інфузія за допомогою катетера та інфузія для блокади периферичних нервів, а також одноразове епідуральне або інтратекальне введення наркотичних засобів.
- Алгоритми щодо внутрішньовенного знеболення, контрольованого пацієнтом (Patient Controlled Analgesia, PCA). Знеболювальними препаратами вибору є фентаніл, гідроморфон і морфін. (Меперидин (Демерол) не схвалений для багаторазового застосування у вигляді PCA, оскільки метаболіт нормеперидин знижує судомний поріг).
Інфузії кетаміну в низьких дозах дозволяють досягти сильного знеболювального ефекту з мінімальними побічними реакціями. Протизапальна дія кетаміну також може послабити системну запальну реакцію, яка спостерігається при травмі.13,23,24 Кетамін зв’язує рецептор NMDA і, окрім прямих знеболювальних властивостей, також дозволяє зменшити загальну дозу наркотичних засобів, необхідних для додаткового знеболення.
Інфузії кетаміну слід виконувати таким чином:
- 250 мг кетаміну в 250 мл фізіологічного розчину.
- У пацієнтів з масою тіла 70 кг і вище та віком до 60 років інфузію слід починати зі швидкістю 10 мг на годину у разі гострого та нейропатичного болю.
- Пацієнтам старше 60 років або з масою тіла менше 70 кг слід вводити 100 мікрограмів/кг/годину кетаміну у разі гострого або нейропатичного болю.
- Анестезіолог або реаніматолог можуть титрувати дози, вказані в стандартному алгоритмі.
Епідуральні катетери
Нейроаксіальне знеболення може бути надзвичайно ефективним засобом лікування болю у пораненого бійця, проте необхідно приділяти особливу увагу безпечному виконанню цієї процедури. До стандартних місцевих анестетиків без консервантів належать ропівакаїн і бупівакаїн. Стандартним препаратом для використання при аеромедичній евакуації є 0,2% ропівакаїн у достатній кількості протягом 3 днів. Перед аеромедичною евакуацією пацієнти повинні отримувати інфузії зі стабільними дозами. Співвідношення ризику й користі від виконання епідуральної анестезії слід враховувати у поранених військовослужбовців із ризиком розвитку венозних тромбоемболічних явищ. У той час як усі антиагреганти та антикоагулянти підвищують ризик кровотечі, застосування низькомолекулярного гепарину (НМГ) у пацієнтів, яким виконують епідуральну анестезію, значно підвищує ризик епідуральної гематоми, яка може призвести до паралічу. Бригада з лікування гострого болю відповідає за підготовку та постійне оновлення регламенту дій, що має включати вказані нижче аспекти.
- У всі катетери слід вводити 3 мл тестової дози місцевого анестетика, що містить принаймні 1:400 000 епінефрину.
- Застосування низькомолекулярного гепарину (НМГ) у пацієнтів, яким виконують епідуральну анестезію, підвищує ризик спінальної або епідуральної гематоми, яка може спричинити тривалий або постійний параліч. Ми рекомендуємо не застосовувати НМГ у пацієнтів, які підлягають аеромедичній евакуації, враховуючи посилену рухливість катетерів під час транспортування пацієнта та, як наслідок, підвищений ризик утворення спінальної та епідуральної гематоми.
- Профілактичне введення НМГ слід виконувати протягом 12 годин до встановлення епідурального катетера.
- Терапевтичне введення слід виконувати протягом 24 годин до встановлення епідурального катетера.
- Уведення НМГ слід відкласти на 2 години після видалення катетера.
- Максимальна рекомендована профілактична доза НМГ із встановленим епідуральним катетером становить 40 мг п/ш на добу.
- Пацієнтам із постійними епідуральними катетерами не рекомендується вводити НМГ двічі на добу.
- Початкову профілактичну дозу НМГ один раз на добу слід вводити лише через 6–8 годин після встановлення катетера. Уведення наступних добових доз слід починати через 24 години після введення першої дози.
Ці рекомендації узгоджуються з останніми рекомендаціями ASRA (Американського товариства регіонарної анестезії) щодо профілактики епідуральної гематоми.
Примітка. З огляду на те, що транспортування наших пацієнтів передбачає участь закладів багатьох рівнів та подолання відстані в тисячі кілометрів, впровадження регіонарної анестезії має бути інтегрованим у всю систему надання допомоги при травмі та має бути безпечним і ефективним. За початкове встановлення епідурального катетера і визначення дози відповідає лікар-анестезіолог. Дозу або швидкість інфузії можуть змінити тільки члени бригади з лікування гострого болю.
Додаток G містить стислий огляд рекомендацій Американського товариства регіонарної анестезії, які стосуються використання НМГ у поранених в умовах бойових дій. Настанови ASRA спочатку були розроблені щодо застосування НМГ у периопераційний період.
Крім того, ці настанови часто оновлюються; останню версію рекомендацій можна знайти на сторінці https://www.asra.com.
Катетери для периферичних нервів
- У всі катетери слід вводити тестову дозу місцевого анестетика, що містить принаймні 1:400 000 епінефрину.
- У пацієнтів, яким виконують блокаду глибокого сплетення або блокаду периферичних нервів, ми радимо застосовувати аналогічні рекомендації щодо нейроаксіальних методів.
- Кожному пацієнту можна встановити не більше двох катетерів, а загальна доза 0,2% ропівакаїну не може перевищувати 20 мл на годину.
- Догляд за пацієнтами, яким було виконано регіонарну анестезію, слід виконувати згідно з критеріями відділення післянаркозної допомоги (post anesthesia care unit, PACU).
Пацієнти, яким було виконано епідуральну анестезію та блокаду периферичних нервів, повинні перебувати в реабілітаційному режимі, поки вони не відповідатимуть стандартним критеріям виписки з відділення PACU та відділення інтенсивної терапії. Пацієнти, яким було виконано блокаду периферичних нервів і встановлено епідуральні катетери, і які відповідають критеріям виписки з відділення інтенсивної терапії та PACU, можуть бути переведені в загальну палату. За всіма пацієнтами зі встановленими епідуральними катетерами або блокадою периферичних нервів слід здійснювати ретельний моніторинг щодо ознак або симптомів компартмент-синдрому (див. нижче). Враховуючи чинну редакцію правил перевезень Повітряних сил США (USAF), у пацієнтів, яким виконується блокада периферичних нервів або епідуральні інфузії, наркотичні засоби застосовуватися не будуть.
Лікування тривоги та ажитації
Враховуючи характер бойових поранень і умови надання допомоги, можна очікувати виникнення і ажитації, і тривоги, тому цьому слід запобігти. У пацієнта з нормальною гемодинамікою оптимальним варіантом для короткочасної седації є пропофол. Пропофол не забезпечує знеболення; він є найчастіше використовуваним препаратом для седації пацієнтів у відділенні інтенсивної терапії та при аеромедичній евакуації з огляду на його швидку дію і виведення. Він є агоністом GABAA зі швидким початком дії та швидким виведенням. Пропофол може викликати артеріальну гіпотензію, тому його слід з обережністю застосовувати у пацієнтів із виснаженням внутрішньосудинного об’єму. Пропофол розчиняють у 10% ліпідному розчині. Це відмінний препарат для пацієнтів у відділенні інтенсивної терапії, для яких заплановано аеромедичну евакуацію. Пропофол слід застосовувати лише у пацієнтів з відновленою прохідністю дихальних шляхів (ендотрахеальна трубка, трахеостомія), стабільною гемодинамікою та під постійним наглядом кваліфікованого персоналу.4,25,26
Дексмедетомідин дедалі частіше використовується у пацієнтів у відділенні інтенсивної терапії та іноді для транспортування. Він мінімальним чином уповільнює дихання, тому його можна використовувати у пацієнтів, які перебувають на неінвазивній штучній вентиляції легень або седації для інтубації у стані неспання. Препарат має легку знеболювальну дію. Його слід з обережністю застосовувати у пацієнтів з брадикардією або блокадою серця. Дексмедетомідин є відносно селективним альфа-2 агоністом; це вдалий препарат для короткочасної седації та анксіолізу. Дексмедетомідин має мінімальний вплив на активність дихального центру, що дозволяє проводити постійну оцінку психічного статусу пацієнта.4
Клонідин — це ефективний препарат для лікування пацієнтів із тривогою та ажитацією; він особливо ефективний для пацієнтів з гіпертензією, пов’язаною з ажитацією.5,27 Клонідин діє як альфа-2-адренергічний агоніст, а також має седативні властивості, які не призводять до пригнічення дихання. Його також можна використовувати для легкої седації та знеболення.27
Лікування делірію
Для лікування делірію широко використовують типовий антипсихотик галоперидол (Haldol®) та атиповий антипсихотик кветіапін (Seroquel®). Кветіапін також можна використовувати як анксіолітик; він особливо ефективний, коли використовується за потреби перед сном, щоб допомогти регулювати сон у пацієнтів із ризиком тривоги та делірію. Обидва ці препарати можуть бути пов’язані з подовженням інтервалу QT, що потенційно може призвести до смертельної аритмії, спричиненої шлуночковою піруетною тахікардією. У разі застосування цих препаратів слід щодня контролювати інтервал QTc за допомогою електрокардіограми (ЕКГ). Застосування препаратів слід припинити, якщо інтервал QTc перевищує 500 мс або інтервал збільшується на 60 мс від вихідного рівня.4
Запобігання ускладненням
Призначення і дозування лікарських засобів визначається з урахуванням конкретної мети, наприклад:
- досягти показника болю 4 або менше;
- підтримувати пацієнта у притомному стані, достатньому для оцінки перебігу поранень за допомогою фізикального огляду;
- зменшити потребу у ШВЛ;
- послабити симптоми тривоги, делірію або ажитації.
Переваги паузи в седації і переривчастого введення ліків
Переривчасте введення
Доведено, що переривчасте введення анальгетиків і анксіолітиків, на відміну від безперервного введення, зменшує тривалість ШВЛ, тому переривчасте введення анальгетиків і анксіолітиків слід починати перед безперервним введенням. Хоча чимало седативних засобів використовують з огляду на їхню коротку тривалість дії (наприклад мідазолам), введення у вигляді безперервної інфузії часто призводить до подовженої тривалості дії внаслідок накопичення активних метаболітів у жировій тканині. За можливості рекомендується використовувати переривчасту седацію. Для пацієнтів, які вимагають введення препарату частіше, ніж кожні 1–2 години, можна використовувати безперервне введення із титруванням дози до досягнення ефекту; проте безперервні інфузії слід якомога раніше перевести на переривчасте введення.
Паузи в седації
Було неодноразово продемонстровано, що щоденні переривання седації («паузи в седації») дозволяють скоротити тривалість перебування на ШВЛ, а також частоту виникнення пневмонії, пов’язаної з ШВЛ.21 Переривчасте введення і щоденні паузи в седації запобігають накопиченню активних метаболітів, які можуть перешкоджати оцінці стану пацієнта протягом тривалого часу.25,28
- Безперервні інфузії слід припиняти щодня, щоб здійснити достовірний фізикальний огляд, включаючи неврологічне обстеження, і виконати спробу спонтанного дихання у пацієнтів на ШВЛ.
- Цілі седації слід переглядати щодня після паузи в седації, а також докладати всіх зусиль для зменшення інфузійних доз.
Протипоказання до щоденної паузи в седації
- Внутрішньочерепна гіпертензія, що не піддається лікуванню.
- Гемодинамічна нестабільність.
- Нездатність забезпечити належну оксигенацію або вентиляцію пацієнтів, які перебувають на ШВЛ.
Додаток H містить зразок медичних алгоритмів, включно з можливими лікарськими засобами та дозами.
Рекомендований алгоритм дій наведено в Таблиці 1 в Додатку A.
Токсичність місцевого анестетика
У пацієнтів, яким встановлено нейроаксіальний катетер або катетер для периферичних нервів, токсичність місцевого анестетика виникає надзвичайно рідко. У разі підозри на токсичність слід негайно припинити всі інфузії місцевого анестетика. Іноді основним симптомом є зупинка серця. У разі зупинки серця пацієнту слід негайно ввести 1,5 мл/кг Інтраліпіду 20% під час непрямого масажу серця та інших заходів розширеної серцево-легеневої реанімації, таких як забезпечення прохідності дихальних шляхів. При стійкій асистолії, електричній активності без пульсу або повторній появі гемодинамічної нестабільності за потреби повторіть болюсне введення 1–2 рази. Якщо гемодинамічна нестабільність не зникає або виникає знову, підвищте швидкість інфузії до 0,5 мл/кг/хв. Продовжуйте інфузію протягом щонайменше 10 хв після відновлення гемодинамічної стабільності; припиніть протягом 1 години, якщо це можливо. Ще одним рідкісним симптомом токсичності місцевого анестетика є судоми. Знов-таки, інфузію слід припинити, для лікування судом застосувати протисудомні препарати і за потреби контролювати прохідність дихальних шляхів. Набагато більш поширеними симптомами токсичності місцевого анестетику є шум у вухах, тривога, неспокій, запаморочення та нечіткий зір; у разі цих симптомів інфузію слід припинити.
Під час аеромедичної евакуації пацієнтам, які отримують інфузії місцевого анестетика, слід ввести 1000 мл Інтраліпіду 20%.
Нудота
Нудота є поширеним побічним ефектом як травми, так і лікарських засобів, які використовуються для лікування болю, тривоги та делірію. Розгляньте можливість профілактичного лікування, коли це можливо, і починайте лікування відразу після того, як пацієнт повідомить про симптоми. Якщо пацієнту нещодавно було виконано екстрений загальний наркоз або будь-яку операцію на черевній порожнині, перед застосуванням лікарських засобів важливо переконатися, що немає ризику аспірації. У разі занепокоєння щодо розтягування шлунка або будь-якого типу обструкції (функціональної чи механічної) на додаток до медикаментозного лікування нудоти пацієнту слід виконати декомпресію шлунка за допомогою назогастрального зонда.
Ондансетрон є безпечним протиблювотним засобом для дорослих пацієнтів і дедалі частіше стає терапією вибору для гострої недиференційованої та пов’язаної з травмою нудоти.29 Він не впливає на свідомість чи активність дихального центру; крім того, дози, рекомендовані для цих пацієнтів (4–8 мг за один прийом), не мають клінічно значущого впливу на інтервал QT.29,30
Компартмент-синдром
Компартмент-синдром є добре вивченим ускладненням травми; у рамках цих настанов CPG розглядатиметься лише компартмент-синдром кінцівки. Остаточним лікуванням вважається повне хірургічне вивільнення компартментів кінцівки. Анестезіолог, відповідальний за лікування гострого болю, та хірург-травматолог повинні детально обговорювати випадки із високим ризиком розвитку компартмент-синдрому. Знеболення може маскувати типову ранню ознаку компартмент-синдрому — посилений біль у компартменті. Своєчасне і ретельне обстеження щодо підвищення тиску в компартментах слід виконувати у всіх пацієнтів із ризиком виникнення компартмент-синдрому кінцівки, які перебувають у свідомості і вимагають підвищеної дози знеболювальних препаратів. У пацієнтів із регіонарною або нейроаксіальною анестезією, що впливає на кінцівку, де може виникнути компартмент-синдром, доцільно частіше виконувати клінічне обстеження і моніторинг кінцівки. Якщо пацієнт не може достовірно виявити біль і повідомити про нього, а також якщо є будь-які клінічні дані або результати обстежень, що можуть вказувати на компартмент-синдром, необхідно негайно виміряти тиск у компартменті або виконати фасціотомію. У разі будь-якої підозри на компартмент-синдром повну фасціотомію слід виконати перед аеромедичною евакуацією. Нові методи моніторингу, такі як спектроскопія у ближній інфрачервоній області, є перспективними методами для раннього неінвазивного виявлення компартмент-синдрому, проте наразі вони не належать до стандартної медичної допомоги.
Аспекти аеромедичної евакуації
У запиті на переміщення пацієнта (Patient Movement Request, PMR) для Повітряних сил США (USAF) слід вказувати тип регіонарної анестезії, що використовується. Усі особи, які беруть участь у догляді за пацієнтом, повинні пройти сучасну підготовку та мати досвід роботи з регіонарною анестезією, технікою виконання, лікарськими засобами та обладнанням. Усе обладнання, пов’язане із застосуванням регіонарної анестезії, має бути схвалене для польоту. Для використання при аеромедичній евакуації схвалено малу портативну інфузійну помпу Ambit. Помпи Ambit слід використовувати для епідуральних катетерів, катетерів периферичних нервів, інфузій кетаміну, інфузій наркотичних знеболювальних та контрольованої пацієнтом анестезії. З метою гарантування безпеки пацієнта під час польоту слід забезпечити координацію між керівником травматологічної бригади, головним льотним хірургом і керівником аеромедичної евакуації у зоні бойових дій, перш ніж виконувати тактичну (в межах театру бойових дій) або стратегічну (між театрами бойових дій) евакуацію літаком.
У разі тривалої аеромедичної евакуації пацієнти перебувають у середовищі з багатьма обмежувальними чинниками протягом відносно короткого періоду. Аеромедичні бригади усвідомлюють, що седацію та знеболення складно підтримувати в умовах турбулентності, особливостей погоди, температури, обмеженого доступу до пацієнтів і обмеженого моніторингу. Може виникнути потреба емпірично збільшити дозу седативних і знеболювальних препаратів, щоб мати запас безпеки, який дозволить захистити ендотрахеальні трубки та інші інвазивні пристрої. Це перешкоджає неврологічному обстеженню пацієнта. Тому пацієнти з потенційним внутрішньочерепним ушкодженням (ЧМТ або інсульт), у яких неможливо виконати стандартне неврологічне обстеження, мають бути підключені до моніторів внутрішньочерепного тиску.
Якщо йдеться про блокаду периферичних нервів або епідуральні катетери, наркотичні засоби до інфузій додавати не слід, оскільки це змінює вимоги допуску до аеромедичної евакуації.
Настанови
Моніторинг покращення показників (ПП)
Цільова популяція
Усі поранені пацієнти
Мета (Очікувані результати)
- У пацієнтів із цільової популяції задокументовано оцінку болю в закладах кожного рівня.
- Пацієнтам із цільової популяції, які перебувають у відділенні інтенсивної терапії, щодня виконують обстеження щодо делірію.
- Відсутність ненавмисної або незапланованої екстубації у всіх інтубованих пацієнтів.
Кількісні показники результативності/Дотримання рекомендацій
- Кількість і відсоток пацієнтів із цільової популяції, у яких задокументовано оцінку болю у закладах кожного рівня.
- Кількість і відсоток пацієнтів із цільової популяції, які перебувають у відділенні інтенсивної терапії, і яким щодня виконують обстеження щодо делірію.
- Кількість і відсоток інтубованих пацієнтів, у яких виникла ненавмисна або незапланована екстубація.
Джерело даних
- Карта пацієнта
- Реєстр травм Міністерства оборони (Department of Defense Trauma Registry, DoDTR)
Системна звітність і частота звітування
Згідно з цими Настановами, вказане вище становить мінімальні критерії моніторингу ПП. Системна звітність виконуватиметься щороку; додатковий моніторинг ПП та заходи із системної звітності можна виконувати залежно від потреб.
Системний перегляд та аналіз даних виконуватиме керівник JTS та Відділ ПП JTS.
Обов’язки
Усі медичні працівники зобов’язані:
- Ознайомитися з настановами щодо лікування болю, тривоги і делірію у пацієнтів у критичному стані.
- Належним чином здійснювати догляд за пацієнтами з болем, тривогою і делірієм.
- Надавати коментарі та пропозиції змін до цих настанов Директору JTS.
Керівник травматологічної бригади, анестезіолог та реаніматолог у кожному закладі III рівня зобов’язані:
- Надавати догляд, що відповідає цим настановам CPG.
- Стежити за дотриманням настанов CPG.
-
- Buckenmaier CC, Rupprecht C, McKnight G, McMillan B, White RL, Gallagher RM, et al. Pain following battlefield injury and evacuation: a survey of 110 casualties from the wars in Iraq and Afghanistan. Pain Med. 2009;10(8):1487-96.
- Buckenmaier C, Mahoney PF, Anton T, Kwon N, Polomano RC. Impact of an acute pain service on pain outcomes with combat-injured soldiers at Camp Bastion, Afghanistan. Pain Med. 2012;13(7):919-26.
- Clark ME, Bair MJ, Buckenmaier CC, Gironda RJ, Walker RL. Pain and combat injuries in soldiers returning from Operations Enduring Freedom and Iraqi Freedom: implications for research and practice. J Rehabil Res Dev. 2007;44(2):179-94.
- Barr J, Fraser GL, Puntillo K, Ely EW, Gélinas C, Dasta JF, et al. Clinical practice guidelines for the management of pain, agitation, and delirium in adult patients in the intensive care unit. Crit Care Med. 2013;41(1):263-306.
- Joshi GP. Multimodal analgesia techniques and postoperative rehabilitation. Anesthesiol Clin North America. 2005;23(1):185-202.
- Kaye AD, Ali SI, Urman RD. Perioperative analgesia: ever-changing technology and pharmacology. Best Pract Res Clin Anaesthesiol. 2014;28(1):3-14.
- Moeller-Bertram T, Keltner J, Strigo IA. Pain and post traumatic stress disorder - review of clinical and experimental evidence. Neuropharmacology. 2012;62(2):586-97.
- Buckenmaier CT. Blood-stained combat boots and acute pain medicine. Pain Med. 2009;10(6):957-8.
- Polomano RC, Chisholm E, Anton TM, Kwon N, Mahoney PF, Buckenmaier C. A survey of military health professionals' perceptions of an acute pain service at Camp Bastion, Afghanistan. Pain Med. 2012;13(7):927-36.
- Nassif TH, Hull A, Holliday SB, Sullivan P, Sandbrink F. Concurrent Validity of the Defense and Veterans Pain Rating Scale in VA Outpatients. Pain Med. 2015.
- Moeller DR. Evaluation of a Removable Intraoral Soft Stabilization Splint for the Reduction of Headaches and Nightmares in Military PTSD Patients: A Large Case Series. J Spec Oper Med. 2013;13(1):49-54.
- Meiler SE. Long-term outcome after anesthesia and surgery: remarks on the biology of a newly emerging principle in perioperative care. Anesthesiol Clin. 2006;24(2):255-78.
- Polomano RC, Buckenmaier CC, Kwon KH, Hanlon AL, Rupprecht C, Goldberg C, et al. Effects of low-dose IV ketamine on peripheral and central pain from major limb injuries sustained in combat. Pain Med. 2013;14(7):1088-100.
- Schweickert WD, Pohlman MC, Pohlman AS, Nigos C, Pawlik AJ, Esbrook CL, et al. Early physical and occupational therapy in mechanically ventilated, critically ill patients: a randomised controlled trial. Lancet. 2009;373(9678):1874-82.
- Schweickert WD, Kress JP. Implementing early mobilization interventions in mechanically ventilated patients in the ICU. Chest. 2011;140(6):1612-7.
- Erstad BL, Puntillo K, Gilbert HC, Grap MJ, Li D, Medina J, et al. Pain management principles in the critically ill. Chest. 2009;135(4):1075-86.
- Curry P, Viernes D, Sharma D. Perioperative management of traumatic brain injury. Int J Crit Illn Inj Sci. 2011;1(1):27-35.
- Losiniecki A, Shutter L. Perioperative management of traumatic brain injury. Curr Treat Options Neurol. 2010;12(2):142-54.
- Beaudoin FL, Lin C, Guan W, Merchant RC. Low-dose ketamine improves pain relief in patients receiving intravenous opioids for acute pain in the emergency department: results of a randomized, double-blind, clinical trial. Acad Emerg Med. 2014;21(11):1193-202.
- Visser E, Schug SA. The role of ketamine in pain management. Biomed Pharmacother. 2006;60(7):341-8.
- Butler FK, Holcomb JB, Giebner SD, McSwain NE, Bagian J. Tactical combat casualty care 2007: evolving concepts and battlefield experience. Mil Med. 2007;172(11 Suppl):1-19.
- Butler FK, Kotwal RS, Buckenmaier CC, Edgar EP, O'Connor KC, Montgomery HR, et al. A Triple-Option Analgesia Plan for Tactical Combat Casualty Care: TCCC Guidelines Change 13-04. J Spec Oper Med. 2014;14(1):13-25.
- Tawfic QA. A review of the use of ketamine in pain management. J Opioid Manag. 2013;9(5):379-88.
- Loix S, De Kock M, Henin P. The anti-inflammatory effects of ketamine: state of the art. Acta Anaesthesiol Belg. 2011;62(1):47-58.
- Kress JP, Pohlman AS, O'Connor MF, Hall JB. Daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation. N Engl J Med. 2000;342(20):1471-7.
- Schweickert WD, Gehlbach BK, Pohlman AS, Hall JB, Kress JP. Daily interruption of sedative infusions and complications of critical illness in mechanically ventilated patients. Crit Care Med. 2004;32(6):1272-6.
- Dowben JS, Grant JS, Keltner NL. Clonidine: diverse use in pharmacologic management. Perspect Psychiatr Care. 2011;47(2):105-8.
- Gorman T, Bernard F, Marquis F, Dagenais P, Skrobik Y. Best evidence in critical care medicine: daily interruption of sedative infusions in critically ill patients undergoing mechanical ventilation. Can J Anaesth. 2004;51(5):492-3.
- Braude D, Crandall C. Ondansetron versus promethazine to treat acute undifferentiated nausea in the emergency department: a randomized, double-blind, noninferiority trial. Acad Emerg Med. 2008;15(3):209-15.
- Onifer DJ, Butler FK, Gross KR, Otten EJ, Patton R, Russell RJ, et al. Replacement of Promethazine With Ondansetron for Treatment of Opioid- and Trauma-Related Nausea and Vomiting in Tactical Combat Casualty Care. J Spec Oper Med. 2015;15(2):17-24.
Додаток А. Настанови щодо болю, тривоги (седації) і делірію
Додаток B. Шкала оцінки болю Міноборони і Міністерства у справах ветеранів США
Додаток C. Додаткові запитання до шкали оцінки болю

Додаток D. Річмондська шкала ажитації — седації (RASS)
Додаток E. Метод оцінки сплутаності свідомості
Додаток F. Акупунктура на полі бою (BFA)
Перед застосуванням BFA слід пройти відповідне навчання в Центрі акупунктури та інтегративної медицини на базі Joint Base Andrews або в іншій схваленій навчальній організації. Виняток становлять лікарі, які не пройшли формального навчання, але володіють необхідними навичками, і які легко можуть засвоїти цю процедуру (тобто хірурги, анестезіологи, персонал відділень невідкладної допомоги та інтенсивної терапії).
Необхідні матеріали: 10 вушних напівстаціонарних голок (Auricular Semi-Permanent, ASP) та спиртові серветки.
Пацієнтам НЕ СЛІД виконувати BFA, якщо:
- У пацієнта активна інфекція у вусі, яке планується використати для акупунктури (виконуйте процедуру лише на неінфікованому вусі)
- Спостерігається ускладнення у вигляді кровотечі (відносне протипоказання)
- Пацієнтка вагітна або може бути вагітною
- Поточне або попереднє утворення колоїдного рубця на одному з вух
Етапи використання голок для акупунктури
Перш ніж виконувати процедуру, прочитайте ВСІ етапи.
- Інформування і згода пацієнта — поясніть процедуру та очікувану тривалість встановлення голки для акупунктури на 2–4 дні із подальшим виконанням повсякденних справ.
- Підготовка ділянки — виконайте дезінфекцію обох вух за допомогою спиртових серветок.
- Встановлення голок для акупунктури
- Почніть із введення голки в найнижчу точку, показану на малюнку нижче (поясна звивина). Почніть з того боку, де пацієнт відчуває найсильніший біль, потім перейдіть на протилежний бік після виконання рухів, описаних для етапу b. Перейдіть до наступного пункту та продовжуйте чергувати сторони, доки біль не зникне (0 або 1 із 10).
- Після кожного введення голки пацієнт повинен зробити 10–20 кроків без сторонньої допомоги або рухати руками/ногами протягом 30–60 секунд, якщо він фізично не може ходити без сторонньої допомоги.
- Якщо під час процедури спостерігаються небажані симптоми, останню вставлену голку слід вийняти, якщо це не викличе зайвих незручностей. Симптоми включають запаморочення, майже повну втрату свідомості, ейфорію або посилення болю.
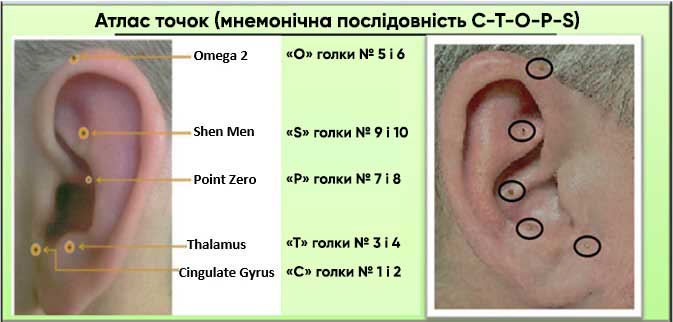
- Догляд після процедури
- Рекомендуйте пацієнтам вести короткі письмові нотатки про свою реакцію на лікування.
- Існує низька ймовірність появи сонливості, запаморочення та (або) ейфорії протягом 30 хвилин після лікування.
- У разі ефективності додаткові процедури акупунктури можна повторювати кожні 5–7 днів.
Детальніша інформація міститься в Посібнику з акупунктури на вебсайті Deployed Medicine.
- Fox LM, Murakami M, Danesh H, Manini A.Battlefield acupuncture to treat low back pain in the emergency department. Am J Emerg Med. 2018 Jun;36(6):1045-1048.
- Niemtzow. (2010). Battlefield Acupuncture. Journal of the Acupuncture Association of Chartered Physiotherapists, Autumn, 55-59.
Додаток G. Особливості застосування регіонарної анестезії
Консенсусна заява Американського товариства регіональної анестезії (ASRA) щодо НМГ у тому, що стосується використання регіонарної анестезії, адаптованої для надання допомоги пораненим в умовах бойових дій.
- Застосування антиагрегантів або пероральних антикоагулянтів у поєднанні з НМГ підвищує ризик спінальної гематоми. ASRA рекомендує не застосовувати одночасно антиагреганти, стандартний гепарин, декстран або кумадин, незалежно від режиму застосування НМГ.
- Встановлення голки слід відкласти принаймні на 10–12 годин після того, як пацієнту було виконано тромбопрофілактику з використанням НМГ.
- Встановлення голки слід відкласти принаймні на 24 години у пацієнтів, яким було виконано терапевтичне введення НМГ.
- Для пацієнтів, яким НМГ вводиться двічі на добу:
- Перед початком режиму застосування двічі на добу слід вийняти постійні катетери.
- Уведення НМГ слід відкласти на 2 години після видалення катетера.
- Для пацієнтів, яким НМГ вводиться один раз на добу:
- Катетери можна не виймати.
- Катетери можна вийняти не швидше ніж через 10–12 годин після введення останньої дози НМГ.
- Подальше введення НМГ слід відкласти на дві години після видалення катетера.
- НПЗП (включаючи аспірин) самі по собі не додають значного ризику виникнення спінальної гематоми.
- У пацієнтів, які отримують НПЗП і НМГ, слід уникати застосування нейроаксіальної анестезії.
- Ці ж рекомендації стосуються пацієнтів, яким виконують блокаду глибокого сплетення або блокаду периферичних нервів.
Додаток H. Медичні алгоритми щодо седації

Додаток D. Річмондська шкала ажитації — седації (RASS)
Додаток E. Метод оцінки сплутаності свідомості
Додаток I. Додаткова інформація щодо застосування за незатвердженими показаннями згідно з CPG
Мета
Мета цього Додатка — надати роз’яснення політики та практики Міноборони щодо включення в Настанови CPG «незатверджених» показань для продуктів, які були схвалені Управлінням з контролю якості продуктів харчування і лікарських засобів США (FDA). Це стосується незатверджених показань при застосуванні у пацієнтів, які належать до збройних сил.
Вихідна інформація
Використання продуктів, схвалених FDA, за незатвердженими показаннями, надзвичайно поширене в медицині США і зазвичай не регулюється окремими нормативними актами. Проте, згідно з федеральним законодавством, у деяких обставинах застосування схвалених лікарських засобів за незатвердженими показаннями підлягає нормативним актам FDA, що регулюють використання «досліджуваних лікарських засобів». До цих обставин належить використання в рамках клінічних досліджень, а також, у військовому контексті, використання за незатвердженими показаннями згідно з вимогами командування. Деякі види використання за незатвердженими показаннями також можуть підлягати окремим нормативним актам.
Додаткова інформація щодо застосування за незатвердженими показаннями згідно з CPG
Включення в Настанови CPG застосувань за незатвердженими показаннями не належить до клінічних випробувань і не є вимогою командування. Більше того, таке включення не передбачає, що армійська система охорони здоров’я вимагає, щоб лікарі, які працюють в структурах Міноборони, застосовували відповідні продукти за незатвердженими показаннями або розглядали їх як «стандарт лікування». Натомість, включення в Настанови CPG застосувань за незатвердженими показаннями допомагає відповідальним медичним робітникам виконувати клінічну оцінку завдяки інформації про потенційні ризики та переваги альтернативних видів лікування. Рішення щодо клінічної оцінки належить відповідальному медичному працівнику в рамках відносин «лікар — пацієнт».
Додаткові процедури
Виважений розгляд
Відповідно до вказаної мети, при розгляді застосувань за незатвердженими показаннями в Настановах CPG окремо вказується, що такі показання не схвалені FDA. Крім того, розгляд підкріплений даними клінічних досліджень, в тому числі інформацією про обережне використання продукту та всі попередження, видані FDA.
Моніторинг забезпечення якості
Процедура Міноборони щодо застосувань за незатвердженими показаннями передбачає регулярний моніторинг забезпечення якості з реєстрацією результатів лікування та підтверджених потенційних побічних явищ. З огляду на це ще раз підкреслюється важливість ведення точних медичних записів.
Інформація для пацієнтів
Належна клінічна практика передбачає надання відповідної інформації пацієнтам. У кожних Настановах CPG, що передбачають застосування за незатвердженими показаннями, розглядається питання інформації для пацієнтів. За умови практичної доцільності, слід розглянути можливість включення додатка з інформаційним листком для пацієнтів, що видаватиметься до або після застосування продукту. Інформаційний листок має в доступній для пацієнтів формі містити такі відомості: a) це застосування не схвалене FDA; b) причини, чому медичний працівник зі структури Міноборони може прийняти рішення використати продукт з цією метою; c) потенційні ризики, пов’язані з таким застосуванням.



























