Мета
Ці настанови містять огляд схвалених підходів до виконання невідкладної ендоваскулярної балонної оклюзії аорти (Resuscitative Endovascular Balloon Occlusion of the Aorta, REBOA) як допоміжного засобу зупинки кровотечі при травматичному шоку та посттравматичній зупинці серця у поранених в умовах бойових дій. Існують оновлені настанови щодо використання REBOA в цивільній клінічній практиці. Використання REBOA у військовому середовищі визначено не настільки добре. Попередні настанови значною мірою спиралися на думку експертів і консенсус авторитетних військових медиків. Цивільні настанови наразі поширюються на добре забезпечені ресурсами цивільні медичні центри, які мають кваліфікованих працівників для надання допомоги постраждалим із травмою. Рекомендації для використання у військовому середовищі мають враховувати унікальні виклики, характерні для бойових умов. Умови військової операції, тактична обстановка, фізичне місцезнаходження пораненого та можливості евакуації також визначають ресурси, доступні для надання допомоги пораненим в умовах бойових дій. Механізм і характер травм, а також доступність та рівень досвіду хірургів та реанімаційних бригад — все це впливає на надання допомоги на полі бою. Лікар, який безпосередньо забезпечує медичний догляд пораненого, перебуває в найкращій ситуації для визначення оптимального лікування. У цьому документі не розглядається використання REBOA при інших показаннях, окрім травми і травматичної кровотечі.
Вихідна інформація
- Кровотеча залишається основною причиною смертельних випадків на полі бою, яким можна було б запобігти. Залежно від місця розташування кровотечу можна класифікувати на ту, яку можна зупинити прямим тиском, і ту, яку ні. Кровотеча з тулуба, яку неможливо зупинити прямим тиском (Non-Compressible Torso Hemorrhage, NCTH) виникає внаслідок травми судин тулуба, легеневої паренхіми, паренхіматозних органів черевної порожнини або таза.1 Оскільки NCTH не піддається зупинці шляхом застосування прямого тиску або накладання турнікета на кінцівку, вона має найбільший ризик летального результату.2
- Невідкладна оклюзія аорти (Resuscitative Aortic Occlusion, RAO) забезпечує дистальну зупинку кровотечі, збільшуючи серцеве післянавантаження і, таким чином, підтримуючи коронарний і церебральний перфузійний тиск до досягнення безпосереднього гемостазу.3 RAO, як правило, вимагає виконання лівобічної торакотомії або лапаротомії для доступу до аорти.4-7 Реанімаційна торакотомія має високий рівень смертності, що значною мірою пов'язано з характером травм, які призводять до зупинки серця.8-10 Проте, дані з театрів бойових дій вказують на те, що існує обґрунтована ймовірність довготривалого виживання та відновлення після RAO у належним чином відібраних поранених, як описано в Настановах з клінічної практики JTS “Невідкладна реанімаційна торакотомія (НРТ)” CPG Emergent Resuscitative Thoracotomy (ERT).11-13
- Не існує якісних доказових даних, які б визначали конкретні показання для проведення REBOA, а також того, що REBOA підвищує виживаність або покращує результати лікування порівняно з НРТ.14 Наявні публікації містять як дані про підвищення виживаності при застосуванні REBOA,15-16 так і дані, які свідчать про те, що REBOA може фактично підвищити смертність.17-18 Поява безпровідникової ЕR-REBOA та краще розуміння показань для проведення REBOA спонукали до проведення нещодавніх досліджень, які демонструють, що REBOA має порівняно не меншу ефективність. У пацієнтів, які не потребують серцево-легеневої реанімації, використання REBOA продемонструвало підвищення виживаності.19-23 За результатами проспективного аналізу найвищої якості, доступному на сьогодні, REBOA при травматичній зупинці серця у пацієнтів із геморагічним шоком підвищувала показники виживаності за межами відділення екстреної допомоги і аж до виписки зі стаціонару порівняно з НРТ.23
- REBOA — це альтернативна форма RAO для пацієнтів з ризиком неминучого серцево-судинного колапсу. Вона виконується через стегнову артерію без необхідності торакотомії. REBOA найкраще виконувати перед серцево-судинним колапсом, коли місце кровотечі міститься нижче діафрагми, а для відкритого торакального втручання немає інших показань.23
- НРТ дозволяє лікувати травми грудної клітки та проводити відкритий масаж серця і, таким чином, залишається процедурою вибору для пацієнтів зі значними травмами грудної клітки або серця. REBOA використовується у поєднанні з відкритою торакотомією та (або) стернотомією як реанімаційний місток для відкритої хірургічної зупинки кровотечі при лікуванні травм магістральних судин грудної клітки.24
Поточні рекомендації
- З перспективи даних клінічних настанов, REBOA залишається протипоказаною у разі масивної кровотечі в ділянці грудної клітки або тампонади перикарда.
- НРТ може покращити серцевий індекс, а також коронарний і церебральний перфузійний тиск порівняно із проведенням закритого масажу серця.26 Однак, коли закритий масаж серця (проведення компресій на закритій грудній клітці) поєднується з REBOA, серцево-легенева реанімація стає більш ефективною, дозволяючи досягти вищого рівня EtCO2 і фракції кардіальної компресії (фракції серцевого викиду при закритому масажі серця) порівняно з відкритим масажем серця і перетисканням аорти.
- ROA (невідкладна оклюзія аорти) становить значний ризик ускладнень, що загрожують життю та кінцівкам. ROA — це критично важливе з точки зору часу втручання, яке не слід виконувати, якщо немає можливості швидкого доступу для остаточної зупинки кровотечі.1-19,7-28,14,17,20
- Етапом, що найбільш істотно може сповільнити REBOA, є виконання прицільного ефективного доступу через загальну стегнову артерію (ЗСА). Доступ під ультразвуковим контролем є найкращим методом доступу через ЗСА, однак до 50% випадків потребують відкритого доступу. Використання менших за розміром інтрод’юсерів пов’язане з кращими результатами процедури.29-32
- Початкові експерименти на тваринах продемонстрували потенційні переваги REBOA з часом оклюзії до 90 хвилин.33-34 Однак тривалий час оклюзії призводив до метаболічних порушень і пошкодження органів, несумісних із життям. Ці побічні ефекти значно зменшувалися при тривалості оклюзії менше 30 хвилин.35
- Результати при REBOA в Зоні 1 можна оптимізувати, якщо час оклюзії становить від 15 до 30 хвилин (ілюстрація зон аорти наведена в Додатку C). Час оклюзії понад 30 хвилин пов’язаний з більшою кількістю ішемічних ускладнень та вищою смертністю.17
- Результати при REBOA в Зоні 3 можна оптимізувати, якщо час оклюзії становить 30–60 хвилин, хоча повідомлялося про виживання і після більш тривалого часу оклюзії.36
- Проспективна база даних Американської асоціації хірургії травм (AAST) під назвою “Оклюзія аорти у невідкладній допомозі при травмі та невідкладних станах у хірургії” (Aortic Occlusion for Resuscitation in Trauma and Acute Care Surgery, AORTA) містить випадки, коли час оклюзії перевищував вищезазначені рекомендації, але цей реєстр не відстежує використання таких методів оклюзії, як періодична (інтермітуюча) та/або часткова (парціальна) REBOA.41 Останні дві методики можуть зменшити дистальну ішемію та подовжити допустимий час оклюзії.37-40 Для досягнення консенсусу щодо цієї практики наразі бракує даних.42,36
- Зі збільшенням доступності REBOA і поглибленням досвіду медиків, REBOA почала успішно використовуватись у багатьох зонах військових конфліктів з обмеженим забезпеченням.43-47 При її застосуванні під час ресусцитації в непристосованих умовах було показано, що REBOA полегшує медичне сортування великої кількості поранених, дозволяє використовувати меншу кількість препаратів крові і допомагає створити «безкровне» середовище для хірургічного лікування з контролем критичних пошкоджень (демедж-контролем).45,47-48
- Належним чином навчені медсестри зобов’язані допомагати в забезпеченні наявності та налаштування обладнання, веденні точної документації та реєстрації глибини введення катетера, а також за безпечну і точну передачу пацієнта під час переміщення / транспортування.
- Реалізація цього методу має визначатися в кожному закладі з урахуванням підготовки, досвіду, місцевих ресурсів і термінів евакуації.
- Документування оклюзії аорти шляхом відкритої торакотомії або REBOA має здійснюватися з використанням Протоколу процедури оклюзії аорти (ОА), що міститься в Додатку Н до цих настанов.
REBOA при лікуванні травматичної зупинки серця і глибокого шоку
Показання до застосування REBOA наведені нижче. Вони повторюють показання до реанімаційної торакотомії, за винятком того, що шок або зупинка серця внаслідок проникаючої травми грудної клітки є відносним протипоказанням до REBOA (див. Настанови з НРТ Emergency Resuscitative Thoracotomy, 18 Jul 2018)13 . Як зазначалося вище, не існує переконливих доказів, які б визначали конкретні показання до REBOA. При порівнянні виживаності та результатів виконання REBOA з НРТ дані, в кращому випадку, є неоднозначними.14,23 Однак є принаймні одне велике дослідження, яке демонструє, що REBOA покращує виживаність за межами відділення екстреної допомоги, а також аж до виписки зі стаціонару в порівнянні з НРТ у пацієнтів з геморагічним шоком, за умови, якщо її було виконано до зупинки серця.23 З цієї причини раннє розпізнавання геморагічного шоку є життєво важливим при визначенні пацієнтів, яким REBOA може принести користь.
Початкове лікування
Пріоритети початкового лікування пацієнтів з травматичною зупинкою серця або ризиком її виникнення включають ранню зупинку кровотечі та ресусцитацію до досягнення гемостазу, як описано в Настановах з клінічної практики JTS “Ресусцитація за принципом контролю критичних пошкоджень” (CPG JTS “Damage Control Resuscitation”).50 Першочерговим завданням у пацієнтів з глибоким геморагічним шоком, включаючи втрату пульсу, є визначення найкращої стратегії ресусцитації, а також визначення того, чи буде ресусцитація доцільною або недоцільною у такого критичного пацієнта. Необхідно швидко визначити таке:
- Механізм і характер ушкоджень
- Наявність пульсу
- Тривалість зупинки серця
- Наявність або відсутність регулярного, вузького комплексу серцевого ритму та (або) регулярної активності серця на УЗД.
- Доступні ресурси
- Кількість поранених в даний момент
Кандидатами на проведення REBOA можуть бути пацієнти, які втрачають кров внаслідок внутрішньочеревної чи тазової кровотечі або кровотечі в ділянці нижніх вузлових зон (ділянки з’єднання тулуба і нижніх кінцівок). Таких пацієнтів ідентифікують за проникаючим механізмом травми черевної порожнини або таза; вибуховим або тупим механізмом з позитивним результатом обстеження FAST; підозрою на перелом таза; масивною травмою проксимальних відділів нижніх кінцівок з ознаками загрози серцево-судинного колапсу.
Перед проведенням REBOA необхідно виключити масивну (знекровлювальну) кровотечу в грудній клітці — це можна зробити за допомогою встановлення плеврального дренажу, торакостомії, рентгенографії або УЗД органів грудної клітки. У разі масивної кровотечі в грудній клітці оклюзія аорти може її посилити, тому для її зупинки найкраще застосовувати торакотомію або стернотомію.
Алгоритм прийняття рішення щодо проведення RAO наведено в Додатку А. Якщо виконується RAO, під час процедури слід продовжувати одночасну ресусцитацію з метою гемостазу, а також закритий масаж серця.51 Якщо RAO не проводиться, реанімаційні заходи слід припинити (якщо немає вагомих підстав розглядати ймовірність нетравматичної зупинки серця).
Реанімаційна торакотомія
Золотим стандартом оклюзії аорти при травматичній зупинці серця залишається лівобічна антеролатеральна торакотомія (див. Настанови з клінічної практики JTS “Невідкладна реанімаційна торакотомія” (Emergent Resuscitative Thoracotomy.)
Трансабдомінальна оклюзія аорти
Оклюзію аорти також можна виконати трансабдомінально в будь-якій точці по всій її довжині. Аорта може бути перекрита як за допомогою затискача, так і шляхом перетискання ретрактором або вручну. Альтернативно можна розглянути балонну оклюзію (див. нижче), оскільки це може зменшити використання інструментів у верхній ділянці черевної порожнини, залежно від того, де знаходиться джерело кровотечі. У пацієнтів з ожирінням, масивним гемоперитонеумом або іншою внутрішньочеревною патологією оптимальнішим може бути трансторакальний або балонний доступ до аорти. Як і при всіх інших формах RAO, відновлення аортальної перфузії слід ретельно координувати із заходами інших членів бригади, щоб мінімізувати наслідки реперфузії та різких змін об'єму крові.
Етапи REBOA
REBOA можна розглядати в рамках 6 послідовних кроків:
- Артеріальний доступ та розміщення інтрод’юсера
- Розміщення балона
- Надування балона
- Оперативна / процедурна зупинка кровотечі
- Здування балона
- Видалення інтрод’юсера
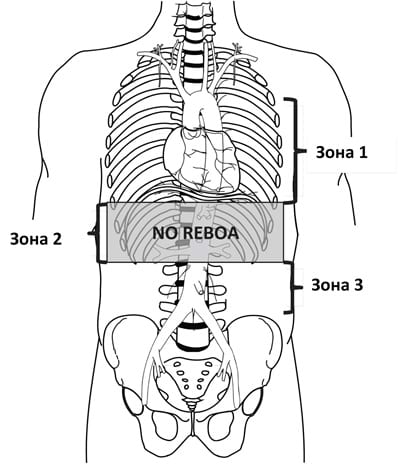
REBOA можна виконувати превентивно у пацієнтів з травмами, що становлять високий ризик, і нестабільними фізіологічними параметрами, як описано вище. Таким чином, у відповідних пацієнтів REBOA може виконуватися в рамках проактивного, а не реактивного підходу. Показання до проведення REBOA наведені в Додатку А у разі травматичної зупинки серця та в Додатку B у разі глибокого шоку. Схема анатомічної будови аорти представлена в Додатку С.52 Якщо необхідно виконати проксимальну оклюзію аорти, це називається Зоною 1, тоді як дистальна оклюзія аорти відома як Зона 3. REBOA в Зоні 1 виконується у більшості пацієнтів з геморагічним шоком і може використовуватися у всіх пацієнтів з травматичною зупинкою серця, незалежно від характеру травми, завдяки перевагам у плані середнього артеріального тиску пацієнта.53
У клінічних ситуаціях, коли розглядається можливість проведення REBOA, рекомендоване попереднє встановлення артеріального катетера в загальну стегнову артерію (ЗСА). Доступ до ЗСА вважається етапом, що обмежує швидкість виконання REBOA.30 Отримання раннього доступу до ЗСА у вигляді встановленого артеріального катетера може значно скоротити час виконання процедури, оскільки попередньо встановлений у ЗСА артеріальний катетер можна швидко замінити на інтрод’юсер для REBOA у разі погіршення стану пацієнта.
Доклінічні дослідження показали, що час оклюзії аорти в Зоні 1 протягом 60 хвилин або більше призводить до значних метаболічних порушень і пошкодження органів, що може звести нанівець будь-яку користь, отриману від ранньої зупинки кровотечі. Оклюзія протягом 30 хвилин значно покращувала результати без ознак серйозних фізіологічних наслідків. Виходячи з цих даних, REBOA в Зоні 1 слід виконувати не довше 30 хвилин. REBOA в Зоні 3 традиційно вважалася прийнятною до 4–6 годин.54-55 Однак нещодавній аналіз доклінічних моделей привів до перегляду рекомендацій щодо цільового часу балонної оклюзії в Зоні 3, який становить тепер менше 30 і не більше, ніж 60 хвилин.54-56,36
Після введення балона REBOA необхідно ретельно стежити за інтрод’юсером. Більшість ускладнень, пов'язаних з проведенням REBOA, стосуються інтрод’юсера та місця доступу. Повідомлялося про такі ускладнення доступу через стегнову артерію, як розрив артерії, розшарування, псевдоаневризми, гематоми, тромбоемболічні явища та ішемія кінцівок. Ці ускладнення призводили до втрати кінцівок.27,28 Через ризик зміщення інтрод’юсера або пошкодження стінки судини слід уникати непотрібних рухів. Пацієнтів із уведеними інтрод’юсерами слід розміщувати або в положення лежачи на спині, або у зворотне положення Тренделенбурга. Якщо пацієнта необхідно перемістити або повернути, його слід утримувати в горизонтальному положенні та перекочувати (лог-рол маневр).
Лікар або асистент повинен негайно задокументувати час введення, артеріальний тиск до та після введення, середній артеріальний тиск, а також глибину введення REBOA. Для цього слід використовувати спеціальний Протокол процедури оклюзії аорти, що наведений у Додатку Н до цих настанов. Він також міститься на вебсайті JTS за адресою https://jts.health.mil/index.cfm/documents/forms_after_action у розділі з бланками для настанов JTS. Об'єм балона та час роздування слід записати біля місця введення (на стегні) для швидкої довідки для всіх лікарів, які будуть надавати допомогу цьому пацієнту. Лікар несе відповідальність за запобігання зміщення (“міграції”) катетера, особливо під час транспортування пацієнта. Лікар, який має досвід ведення пацієнтів з REBOA, повинен спостерігати за пацієнтом в очікуванні остаточного хірургічного втручання, в тому числі під час транспортування. Підготовлений лікар відповідає за безпечну та компетентну передачу пацієнта.
Поки інтрод’юсер на місці, слід щогодини проводити оцінку стану нервів та судин обох нижніх кінцівок. Ці обстеження слід продовжувати протягом 24 годин після видалення інтрод’юсера, щоб забезпечити раннє виявлення та своєчасне втручання в разі ускладнень у місці доступу. Крім того, подальше ультразвукове дуплексне сканування місця доступу (через 24–48 годин після REBOA) дозволяє на ранніх стадіях виявити та вилікувати будь-які ускладнення в цій ділянці. Ультразвукове дуплексне сканування можна виконати або в закладі 3 етапу медичної допомоги, або якнайшвидше після прибуття до закладу 4 етапу, залежно від наявних ресурсів для проведення та інтерпретації ультразвукового дослідження.
Після остаточної зупинки кровотечі інтрод’юсер REBOA слід вийняти і застосувати прямий тиск на місце доступу (на ЗСА) протягом 30 хвилин. Якщо все ще необхідно виконувати інвазивний моніторинг артеріального тиску, слід розглянути альтернативне місце розташування артеріального катетера. Для документування перфузії дистальних відділів кінцівок найкращою практикою, хоча і не завжди доступною, є виконання ангіографії через інтрод’юсер. Якщо використовується інтрод’юсер великого розміру, пацієнт страждає на коагулопатію або є технічні труднощі із видаленням інтрод’юсера, може знадобитися розсічення з подальшою реконструкцією артерії (ушивання, використання судинних сегментів чи трансплантатів). Найкраще це виконувати в закладі 3 етапу з доступом до вузьких спеціалістів та (або) достатніх хірургічних ресурсів.21
Балон слід здути, як тільки буде досягнутий контроль над кровотечею з конкретної судини або остаточна зупинка кровотечі. Вирішальне значення перед тим, як розглядати здування балона, має комунікація з асистентом, який тримає апарат, що фіксує катетер, та анестезіологічною бригадою. Коли ви збираєтесь здувати балон, поверніть триходовий інфузійний кран і повільно відтягуйте шприцом фізіологічний розчин, обережно здуваючи балон, оскільки цей етап потенційно може призвести до значного зниження післянавантаження та гіпотензії, що може спричинити серцевий колапс. Під час повільного здування балона може знадобитися проведення додаткових заходів ресусцитації. Після того, як балон буде здутий, бригада повинна очікувати можливі гемодинамічні зміни, пов'язані з реперфузією, вимиванням продуктів метаболізму та ацидозом. Враховуючи це, під час ресусцитації може знадобитися періодичне/інтермітуюче надування та здування балона, поки не відновиться гемодинамічна стабільність.
Навіть у середовищі з непристосованими умовами слід планувати та обговорювати протоколи виконання процедури та подальшого ведення пацієнта перед їх впровадженням. Підготовка бригади та обізнаність щодо “підводних каменів” мають вирішальне значення для забезпечення найкращих можливих результатів.
Якщо остаточної зупинки кровотечі не досягнуто, допустимим варіантом може бути залишити інтрод’юсер на місці без оклюзії аорти. Якщо не виймати інтрод’юсер, катетер для REBOA можна легко знов увести і швидко досягти оклюзії аорти у випадку виникнення повторної/продовження існуючої кровотечі.38 Загалом, залежно від ситуації/ресурсів, інтрод’юсер слід залишати на місці під час будь-якої активної або тривалої ресусцитації. Інтрод’юсер не слід виймати безпосередньо перед транспортуванням; найкраще виймати його в закладі, де існує можливість лікування та подальшого ведення судинних ускладнень.
Категорично забороняється залишати інтрод’юсер при передачі пацієнта в медичний заклад країни, на території якої проводяться бойові дії.
Аспекти аеромедичної евакуації
У пацієнтів, яким виконують REBOA в закладі 2 етапу і які потребують евакуації на вищий рівень надання медичної допомоги, перед транспортуванням необхідно забезпечити зупинку кровотечі та здути балон. За жодних обставин не дозволяється залишати надутим балон REBOA, розташований у Зоні 1, під час транспортування. У рідкісних випадках, коли можлива евакуація на вищий рівень надання медичної допомоги вертольотом на короткі відстані, балон REBOA в Зоні 3, встановлений в закладі 2 етапу, може залишатися надутим під час транспортування, однак такі ситуації є скоріше вийнятковими і вимагають ефективної комунікації та планування, щоб уникнути надмірного ризику ішемічної травми.
Якщо доступний вертолітний транспорт, пораненого повинен постійно супроводжувати медичний працівник, який має навички моніторингу гемодинаміки та маніпуляцій з оклюзійним балоном. Якщо у пораненого з травмою встановлено інтрод’юсер REBOA, то у випадку раптової глибокої гіпотензії прийнятним є варіант повторного введення/повторного роздування балона кваліфікованим лікарем під час транспортування. Необхідно також одночасно проводити гемотрансфузію, а час перебування роздутого балона у Зоні 1 не повинен перевищувати 15 хвилин.
Необхідне обладнання для виконання REBOA наведено в Додатку D, а відповідні технічні кроки та особливості підсумовано в Додатку E.
Навчання
Перед тим, як використовувати REBOA, лікарі повинні отримати ґрунтовні знання про пристрій, показання до застосування, особливості використання та потенційні ускладнення. У ЗС США доступні організовані структуровані курси з використання REBOA, такі як курс «Базові ендоваскулярні навички при травмі» (Basic Endovascular Skills for Trauma, BEST) або «Допоміжні засоби при ресусцитації: догоспітальне переливання крові і REBOA» (Resuscitation Adjuncts: Prehospital Transfusion & REBOA, RAPToR) від Американського коледжу хірургів (American College of Surgeon). Перед використанням пристрою рекомендується успішно завершити курс із проведення REBOA, що включає теоретичну та практичну складову. Опанувати навички можна шляхом високореалістичної симуляції, тренування на трупах із забезпеченням перфузії або тренування на живих тканинах. До критично важливих навичок належать виконання доступу до ЗСА під контролем ультразвуку, виконання розрізу, розміщення та позиціонування інтрод’юсера, а також робота з системою REBOA та її видалення. Анатомічно правильні моделі мають вирішальне значення для точного тренування навичок доступу до ЗСА, тому для виконання цієї вимоги рекомендується використовувати трупи із забезпеченням перфузії.57-59
Зрештою, рішення про проведення REBOA у пацієнтів з високим ризиком смерті від крововтрати буде залежати від механізму і патерну конкретної травми, індивідуального досвіду лікаря, підготовки бригади та місцевих ресурсів.
Застосування REBOA нехірургічними реанімаційними бригадами
Спеціалізовані реанімаційні бригади можуть використовувати цей підхід в середовищі з непристосованими умовами як перехідний етап перед хірургічною зупинкою кровотечі. Даних про ефективність такого підходу недостатньо. REBOA в такому контексті може розглядатися в тих рідкісних випадках, коли задовольняються всі наведені нижче умови:
- Без виконання REBOA поранений помре в межах 15–30 хвилин (кровотеча з тулуба, яку неможливо зупинити прямим тиском, рефрактерний геморагічний шок)
- В закладі є лікар, який має досвід виконання REBOA
- Доступна ресусцитація препаратами крові (бажано цільної), але її проведення у даного пацієнта не має успіху
- Час до остаточної зупинки кровотечі короткий (в ідеалі <15 хв для Зони 1, <30 хв для Зони 3).
Основним обмеженням REBOA є вузьке терапевтичне вікно для оклюзії аорти. Наразі вивчаються такі методи подовження часу оклюзії аорти, як часткова REBOA (partial REBOA, pREBOA), інтермітуюча/періодична REBOA (intermittent REBOA, iREBOA), регіональна гіпотермія та фармакологічні втручання для зменшення ішемії або підвищення резистентності до ішемії. Доступно чимало публікацій з описами методів pREBOA та iREBOA на тваринних моделях. В одному з протоколів, рекомендованих Комітетом з надання допомоги пораненим в умовах бойових дій (CoTCCC), iREBOA описується як початкова 15-хвилинна оклюзія, за якою слідує здування балона і повторна оцінка систолічного артеріального тиску (САТ) пацієнта. Якщо САТ > 80 мм рт.ст., балон слід залишити здутим. Якщо САТ падає < 80 мм рт.ст., балон слід повторно роздути. Якщо САТ опустився нижче 80 мм рт.ст. швидше, ніж за 3 хвилини, балонну оклюзію слід підтримувати до 30 хвилин із одночасним проведенням ресусцитації. Якщо ж декомпенсація настала пізніше, ніж через 3 хвилини, балон слід повторно роздути, а через 10 хвилин знову здути для повторної оцінки. Цей цикл повторюється до сумарного часу оклюзії до 120 хв або доти, доки артеріальний тиск пацієнта стабільно залишатиметься вищим 80 мм рт.ст. Методику iREBOA критикують через численні обмеження початкового дослідження і відсутність інших підтверджувальних досліджень.37-38,42,60
“Підводні камені” при проведенні REBOA
- Рішення про проведення REBOA може бути прийнято занадто пізно. Після втрати пульсу, як і при проведенні НРТ, спостерігається висока смертність.
- Система REBOA може бути введена занадто низько, нижче ділянки біфуркації стегнової артерії. Катетер слід вводити в загальну стегнову артерію, безпосередньо під паховою зв'язкою. Введення в поверхневу стегнову артерію пов'язане з підвищеним ризиком тромбозу і втрати кінцівки.
- Система REBOA може бути введена занадто низько, нижче точки роздвоєння стегнової артерії. Катетер слід встановити в загальну стегнову артерію, трохи нижче пахвинної зв'язки. Введення в поверхневу стегнову артерію пов'язане з підвищеним ризиком тромбозу і втрати кінцівки.
- Невиявлена проксимальна транссекція (розрив) стегнової або клубової артерії, що перешкоджає ендоваскулярному доступу з того боку, де виявлено ушкодження. Це може статися при проникаючій травмі таза або тяжкому переломі кісток таза — перевірте пульс на стегновій артерії на обох кінцівках і виконайте доступ на стороні із сильнішим пульсом, якщо є різниця. Не вагайтеся, якщо потрібно перейти на протилежну сторону в паховій ділянці або виконати торакотомію.
- Нездатність усунути патологічні стани в грудній клітці. Завжди оцінюйте стан грудної клітки за допомогою рентгену, ультразвуку або встановлення плевральних дренажів з обох боків, щоб виявити та усунути значний гемоторакс або пневмоторакс. Перейдіть до торакотомії для усунення масивного гемотораксу.
- Катетер або провідник можуть не проходити вільно. Це може свідчити про пошкодження судини. Не роздувайте балон. Розгляньте можливість доступу з протилежного боку або перейдіть до торакотомії.
- Надмірне роздування балона. Об'єм балона ER-REBOA становить 24 мл. Для досягнення оклюзії в Зоні 1 може знадобитися лише 8 мл, а в Зоні 3 — лише 2 мл. Надмірне надування може призвести до розриву балона або пошкодження аорти.
- Надто довге перебування балона в роздутому стані. Рекомендовано підтримувати оклюзію в Зоні 1 лише 30 хвилин — і чим менше, тим краще. Забезпечте швидкий контроль ділянок кровотечі за допомогою тимчасових заходів, таких як накладання затискачів, для якнайшвидшого відновлення перфузії; більшість втручань, таких як накладання швів, лігування, видалення паренхіматозних органів і створення судинних шунтів, можна виконувати після здування балона. У літературі є повідомлення про смертельний випадок внаслідок ішемічного ушкодження при більш тривалому часі оклюзії.
- Нездатність працювати в умовах підвищеного рівня ургентності після виконання REBOA. У деяких пацієнтів може спостерігатися відновлення «стабільного» стану, проте балонна оклюзія аналогічна в цьому відношенні використанню затискача та призводить до таких же ускладнень у вигляді вісцеральної та спінальної ішемії. Необхідно докласти всіх зусиль для якнайшвидшого відновлення перфузії, щоб обмежити ішемію.
- Неналежна фіксація катетера REBOA після роздування балона, що призводить до міграції балона. Положення катетера необхідно зберігати під час і після роздування, щоб уникнути дистальної міграції, поки не відновиться тиск і пульс в аорті.
- Надто швидке здування балона - ще до забезпечення належної рідинної ресусцитації. Переконайтеся, що анестезіологічна бригада готова до ознак реперфузії перед тим, як почати здувати балон.
- Передчасне видалення артеріального інтрод’юсера. Інтрод’юсер слід залишати на місці, якщо у пацієнта спостерігається коагулопатія, тривала кровотеча в черевній порожнині або порожнині таза, або якщо його транспортують у межах театру бойових дій у заклад вищого рівня.
- Пошкодження в місці артеріального доступу. Після видалення інтрод’юсера уважно стежте за відповідною нижньою кінцівкою щодо повторної кровотечі та утворення тромбу/ пошкодження інтими. Зниження перфузії нижніх кінцівок може потребувати подальшої ангіографії, тромбектомії або безпосередньої реконструкції артерії.
- Витрачання значних ресурсів на недоцільні реанімаційні заходи. Враховуйте потреби проведення масивної трансфузії, задіяного персоналу, хірургічних матеріалів, ризик перерозподілу ресурсів від поранених з більшою ймовірністю збереження життя тощо.
Міркування щодо майбутнього
Ретроспективний аналіз прогалин у можливостях Об'єднаного реєстру бойових травм Великої Британії показав, що один із п’яти тяжкопоранених бійців має рани, які потенційно можна лікувати з використанням REBOA.61 Розробка катетера 7 Fr ER REBOA полегшує введення пристрою і може сприяти більш широкому використанню цього підходу в непристосованому середовищі з обмеженим забезпеченням. Наразі вивчаються питання підготовки бойових медиків та парамедиків для проведення REBOA на догоспітальному етапі.62-63 Часткова REBOA, періодична REBOA, регіональна гіпотермія та фармакологічні засоби все ще проходять оцінку як засоби подовження часу оклюзії аорти.60,39,64 Поточні дослідження спрямовані на визначення модифікацій техніки REBOA, які можуть знадобитися при її поєднанні з іншими методами ресусцитації, такими як застосування транексамової кислоти. Дослідники також намагаються уточнити критерії відбору пацієнтів, оцінюючи вплив REBOA на торакальну і черепно-мозкову травму.65 Всі ці досягнення повинні вдосконалити оптимальне використання цього допоміжного засобу під час ресусцитації. Накопичення довгострокових даних в цивільному та військовому середовищі допоможе визначити ідеальну клінічну ситуацію, в якій REBOA може принести максимальну користь.
Показники покращення ефективності (ПЕ)
Досліджувана група
- Пацієнти із пораненням грудної клітки, черевної порожнини, таза та/або нижніх кінцівок зі ступенем тяжкості ≥ 3 балів за шкалою AIS та САТ 0-90 мм рт. ст. або у стані раптової зупинки кровообігу та проведення серцево-легеневої реанімації на момент поступлення у перший військово-медичний заклад ТА з поєднаною травмою голови (для голови/обличчя/шиї = 5 або 6 балів за шкалою AIS).
- Пацієнти, яким виконано REBOA.
Мета (очікувані результати)
- REBOA не виконується у пацієнтів без ознак життя, або у пацієнтів, яким серцево-легенева реанімація виконується довше 15 хвилин, або у пацієнтів з ізольованою ЧМТ тяжкого ступеня, проникаючим пораненням шиї або проникаючим пораненням кінцівки.
- У разі проведення, REBOA виконувалася у зв’язку із геморагічним шоком, пов'язаним із внутрішньочеревною чи тазовою кровотечею або вузловою кровотечею (в ділянці з’єднання тулуба і нижніх кінцівок), або є чітко задокументоване інше показання.
- Якщо було виконано REBOA, у пацієнта визначали наявність торакальної кровотечі (задокументовано результати EFAST чи рентгенографії грудної клітки або було встановлено плевральні дренажі з обох боків).
- Артеріальний тиск до і після REBOA та час застосування балона (роздування і здування) задокументовані в протоколі виконання REBOA.
- Пульс на нижніх кінцівках після здування балона оцінено та задокументовано.
Показники результативності / дотримання рекомендацій
- Кількість та відсоток пацієнтів, яким було виконано REBOA у зв’язку із геморагічним шоком, пов'язаним із внутрішньочеревною чи тазовою кровотечею або вузловою кровотечею.
- Кількість та відсоток пацієнтів, яким було виконано REBOA, у яких визначали наявність торакальної кровотечі (задокументовано результати EFAST чи рентгенографії грудної клітки або було встановлено плевральні дренажі з обох боків).
- Кількість та відсоток пацієнтів, яким було виконано REBOA, і для яких було заповнено протокол виконання REBOA, що включає задокументований артеріальний тиск до та після REBOA та задокументований час застосування балона (роздування та здування).
- Кількість та відсоток пацієнтів, яким було виконано REBOA, у яких після здування балона було задокументовано пульс на нижніх кінцівках.
- Кількість та відсоток пацієнтів, яким було виконано REBOA з хірургічною процедурою зупинки кровотечі або для яких задокументовано, що така процедура не була потрібна.
- Кількість і відсоток пацієнтів, яким було виконано НРТ або REBOA у досліджуваній групі.
- Кількість і відсоток пацієнтів, яким не було виконано НРТ або REBOA у досліджуваній групі.
- Кількість і відсоток пацієнтів, яким було виконано НРТ або REBOA, і які вижили через 24 години, 7 днів, 30 днів (вважаються живими, якщо їх було виписано живими перед досягненням кожної із вказаних часових точок).
- Кількість і відсоток пацієнтів у досліджуваній групі, яким не було виконано НРТ або REBOA, і які були оголошені убитими в бою/померлими на час прибуття медиків, або які вижили через 24 години, 7 днів, 30 днів (вважаються живими, якщо їх було виписано живими перед досягненням кожної із вказаних часових точок).
Джерела даних
- Медична картка пацієнта
- Реєстр травм Міністерства оборони США (Department of Defense Trauma Registry, DoDTR)
Збір даних і звітування щодо ПЕ
- Керівник Відділу ПЕ JTS щоквартально повинен подавати звіти керівнику JTS щодо кількості виконаних REBOA, ходу виконання процедури та показників дотримання вимог.
- JTS ідентифікуватиме пацієнтів, яким було виконано REBOA, в реєстрі травм і сприятиме збору повної медичної документації.
Системна звітність та її частота
Згідно з даними настановами, вказане вище становить мінімальні критерії моніторингу ПЕ. Системна звітність проводитиметься щороку; додатковий моніторинг ПЕ та системну звітність можна проводити залежно від потреб.
Системний огляд та аналіз даних виконуватиме керівник Об’єднаної системи лікування травм (JTS) та відділ ПЕ JTS.
Обов’язки
Керівник команди з надання допомоги при травмах відповідає за ознайомлення з даними Настановами з клінічної практики, належне дотримання вказаних у ній вимог та моніторинг ПЕ на місцевому рівні.
-
- Morrison JJ, Rasmussen TE. Noncompressible torso hemorrhage: a review with contemporary definitions and management strategies. Surg Clin North Am 2012;92(4):843–58, vii.
- Stannard A, Morrison JJ, Scott DJ, et al. The epidemiology of noncompressible torso hemorrhage in the wars in Iraq and Afghanistan. J Trauma Acute Care Surg 2013;74(3):830–4.
- Mattox KL, Feliciano DV. Role of external cardiac compression in truncal trauma. J Trauma 1982;22(11):934–6.
- Mattox KL, Wall MJ, Tsai P. Trauma thoracotomy: principles and techniques. In: Mattox KL, Moore EE, Feliciano DV, editors. Trauma. New York: McGraw Hill Medical; 2013. p. 461–7.
- Ledgerwood AM, Kazmers M, Lucas CE. The role of thoracic aortic occlusion for massive hemoperitoneum. J Trauma 1976;16(08):610–5.
- Burlew CC, Moore EE, Moore F a, et al. Western Trauma Association critical decisions in trauma: resuscitative thoracotomy. J Trauma Acute Care Surg 2012;73(6):1359–63.
- Working Group Ad Hoc Subcommittee on Outcomes, American College of Surgeons-Committee on Trauma. Practice Management Guidelines for Emergency Department Thoracotomy. J Am Coll Surg 2001;193(3):303–9.
- Seamon MJ, Fisher CA, Gaughan JP, Kulp H, Dempsey DT, Goldberg AJ. Emergency department thoracotomy: survival of the least expected. World J Surg 2008;32(4):604–12.
- Branney SW, Moore EE, Feldhaus KM, Wolfe RE. Critical analysis of two decades of experience with postinjury emergency department thoracotomy in a regional trauma center. J Trauma 1998;45(1):85–7.
- Passos EM, Engels PT, Doyle JD, et al. Societal costs of inappropriate emergency department thoracotomy. J Am Coll Surg 2012;214(1):18–25.
- Edens JW, Beekley AC, Chung KK, et al. Longterm outcomes after combat casualty emergency department thoracotomy. J Am Coll Surg 2009;209(2):188–97.
- Mitchell TA, Waldrep KB, Sams VG, et al. An 8-year review of Operation Enduring Freedom and Operation Iraqi Freedom resuscitative thoracotomies. Mil Med 2015;180(3):S33-S36.
- Joint Trauma System, Emergent Resuscitative Thoracotomy Clinical Practice Guideline, 18 Jul 2018; https://jts.health.mil/index.cfm/PI_CPGs/cpgs Accessed Mar 2020.
- Joseph B, Zeeshan M, Sakran JV, et al. Nationwide analysis of resuscitative endovascular balloon occlusion of the aorta in civilian trauma. JAMA Surg 2019;154:500.
- Moore L, Brenner M, Kozare RA, et al. Implementation of resuscitative endovascular balloon occlusion of the aorta as an alternative to resuscitative thoracotomy for noncompressible truncal hemorrhage. J Trauma Acute Care Surg 2014;79:523-532.
- Abe T, Uchida M, Nagata I, et al. Resuscitative endovascular balloon occlusion of the aorta versus aortic cross clamping among patients with critical trauma: a nationwide cohort study in Japan. Crit Care 2016;20:400-410.
- Inoue J, Shiraishi A, Yoshiyuki A, Haruta K, Matsui H, Otomo Y. Resuscitative endovascular balloon occlusion of the aorta might be dangerous in patients with severe torso trauma: A propensity score analysis. J Trauma Acute Care Surg 2016;80:559-567.
- Norii T, Crandall C, Terasaka Y. Survival of severe blunt trauma patients treated with resuscitative endovascular balloon occlusion of the aorta compared with propensity score/adjusted untreated patients. J Trauma Acute Care Surg. 2015;78:721-728.
- Perina DG, Kang CS, Bulger EM, et al. Authors' Response to Letter to the Editor by Allen et al regarding Joint statement from the American College of Surgeons Committee on Trauma (ACS COT) and the American College of Emergency Physicians (ACEP) regarding the clinical use of Resuscitative Endovascular Balloon Occlusion of the Aorta (REBOA) by Brenner et al. Trauma Surg Acute Care Open. 2018 Mar 6;3(1):e000172.
- Manzano-Nunez R, Orlas CP, Herrera-Escobar JP, et al. A meta-analysis of the incidence of complications associated with groin access after the use of resuscitative endovascular balloon occlusion of the aorta in trauma patients. J Trauma Acute Care Surg. 2018 Sep;85(3):626-634.
- Taylor JR, Harvin JA, Martin C, Holcomb JB, Moore LJ. Vascular complications from resuscitative endovascular balloon occlusion of the aorta: life over limb? J Trauma Acute Care Surg. 2017;83(1 Suppl1):S120–S123.
- DuBose JJ1, Scalea TM, Brenner M, Skiada D, et al. The AAST prospective Aortic Occlusion for Resuscitation in Trauma and Acute Care Surgery (AORTA) registry: Data on contemporary utilization and outcomes of aortic occlusion and resuscitative balloon occlusion of the aorta (REBOA). J Trauma Acute Care Surg. 2016 Sep;81(3):409-19
- Brenner M, Inaba K, Aiolfi A, DuBose J, et al. Resuscitative Endovascular Balloon Occlusion of the Aorta and Resuscitative Thoracotomy in select patients with hemorrhagic shock: early results from the American Association for the Surgery of Trauma's Aortic Occlusion in Resuscitation for Trauma and Acute Care Surgery Registry. J Am Coll Surg. 2018 May; 226(5):730-740.
- Ordoñez CA, Parra MW, Manzano-Nunez R, et al. Intraoperative combination of resuscitative endovascular balloon occlusion of the aorta and a median sternotomy in hemodynamically unstable patients with penetrating chest. J Trauma Acute Care Surg. May 2018; 84(5):752–757,
- Boczar ME, Howard MA, Rivers EP, et al. A technique revisited: Hemodynamic comparison of closed- and open-chest cardiac massage during human cardiopulmonary resuscitation. Critical Care Medicine. 23(3):498-503, March 1995.
- Doucet J, Coimbra R. REBOA: is it ready for prime time? J Vasc Bras 2017;16:1–3. Norii T, Crandall C, Terasaka Y. Survival of severe blunt trauma patients treated with resuscitative endovascular balloon occlusion of the aorta compared with propensity score-adjusted untreated patients. J Trauma Acute Care Surg 2015;78:721–8.
- Davidson AJ, Russo RM, Reva VA, et al. The pitfalls of REBOA: risk factors and mitigation strategies. J Trauma Acute Care Surg 2017;84:192–202.
- Ribeiro Junior MAF, Feng CYD, Nguyen ATM, et al. The complications associated with resuscitative endovascular balloon occlusion of the aorta (REBOA). World J Emerg Surg 2018;13:20.
- Matsumura Y, Matsumoto J, Kondo H, et al. Early arterial access for REBOA is related to survival outcome in trauma. J Trauma Acute Care Surg 2018;1.
- Romagnoli A, Teeter W, Pasley J, et al. Time to aortic occlusion: it’s all about access. J Trauma Acute Care Surg 2017;83:1161–4.
- Brenner M, Moore L, Teeter W, et al. Exclusive clinical experience with a lower profile device for resuscitative endovascular balloon occlusion of the aorta (REBOA). Am J Surg 2019;217:1126–9.
- Matsumura Y, Matsumoto J, Kondo H, et al. Fewer REBOA complications with smaller devices and partial occlusion: evidence from a multicentre registry in Japan. Emerg Med J 2017;34:793–9.
- Markov NP, Percival TJ, Morrison JJ, et al. Physiologic tolerance of descending thoracic aortic balloon occlusion in a swine model of hemorrhagic shock. Surgery 2013;153(6):848–56.
- Brenner ML, Moore LJ, Dubose JJ, et al. A clinical series of resuscitative endovascular balloon occlusion of the aorta for hemorrhage control and resuscitation. J Trauma Acute Care Surg 2013;75(3):506–11.
- Kauvar DS, Dubick MA, Martin MJ. Large animal models of proximal aortic balloon occlusion in traumatic hemorrhage: review and identification of knowledge gaps relevant to expanded use. J Surg Res 2019;236:247–58.
- Bulger EM, Perina DG, Zaffer Q,et al. Clinical use of resuscitative endovascular balloon occlusion of the aorta (REBOA) in civilian trauma systems in the USA, 2019: a joint statement from the American College of Surgeons Committee on Trauma, the American College of Emergency Physicians, the National Association of Emergency Medical Services Physicians and the National Association of Emergency Medical Technicians. Trauma Surg Acute Care Open 2019;4:e000376.doi:10.1136/tsaco-2019-000376
- Kuckelman JP, Barron M, Moe D, et al. Extending the golden hour for zone 1 resuscitative endovascular balloon occlusion of the aorta: improved survival and reperfusion injury with intermittent versus continuous resuscitative endovascular balloon occlusion of the aorta in a porcine severe truncal hemorrhage model. J Trauma Acute Care Surg. 2018;85(2):318–326.
- Butler FK Jr, Holcomb JB, Shackelford S, et al. Advanced resuscitative care in tactical combat casualty care: TCCC Guidelines Change 18-01:14 October 2018. J Spec Oper Med. Winter 2018;18(4):37-55.
- Johnson MA, Tibbits EM, Hoareau GL, et al. Endovascular perfusion augmentation for critical care: partial aortic occlusion for treatment of severe ischemia-reperfusion shock. Shock. 2019 May;51(5):659-666.
- Johnson MA, Williams TK, Ferencz SE, et al. The effect of resuscitative endovascular balloon occlusion of the aorta, partial aortic occlusion and aggressive blood transfusion on traumatic brain injury in a swine multiple injuries model. J Trauma Acute Care Surg. 2017 Jul; 83(1):61-70.
- Brenner M, Bishoy Z, Coimbra R, AAST Multi-Institutional Trials Committee, et al. Right into the danger zone: complications of Resuscitative Endovascular Balloon Occlusion of the Aorta (REBOA) at zone 1 and 3 from the AAST aortic occlusion for resuscitation in trauma and acute care surgery (AORTA) trial. Presented at the 2019 AAST meeting.
- Williams T, Neff L, Johnson, MA. Letter to the Editor: Intermittent REBOA Translational Science Papers, Journal of Trauma and Acute Care Surgery: Aug 28, 2019 - Volume Publish Ahead of Print - Issue – p doi: 10.1097/TA.0000000000002496
- Fisher AD, Teeter WA, Cordova CB, et al. The Role I Resuscitation Team and Resuscitative Endovascular Balloon Occlusion of the Aorta. J Spec Oper Med. Summer 2017;17(2):65-73.
- Glaser J, Teeter W, Fernandez N. Resuscitative Endovascular Balloon Occlusion of the Aorta (REBOA) as an adjunct to damage control surgery for combat trauma. Journal of Endovascular Resuscitation and Trauma Management, [S.l.], v. 1, n. 1, p. 58-62, Aug. 2017.
- Manley JD, Mitchell BJ, Dubose JJ, et al. A modern case series of Resuscitative Endovascular Balloon Occlusion of the Aorta (REBOA) in an out-of-hospital, combat casualty care setting. J Spec Oper Med 2017; 17 (1), 1-8.
- Reva VA, Hörer TM, Makhnovskiy AI. Field and en route resuscitative endovascular occlusion of the aorta: A feasible military reality? J Trauma Acute Care Surg. 2017 Jul;83(1 Suppl 1):S170-S176.
- Northern DM, Manley JD, Lyon R, et al. Recent advances in austere combat surgery: Use of aortic balloon occlusion as well as blood challenges by special operations medical forces in recent combat operations. J Trauma Acute Care Surg. 2018 Jul;85(1S Suppl 2):S98-S103
- Lyon RF, Northern DM. REBOA by a non-surgeon as an adjunct during MASCAL. Am J Emerg Med. 2018 Jun;36(6):1121.e5-1121.e6. doi: 10.1016/j.ajem.2018.02.013. Epub 2018 Feb 13.
- Biffl WL, Fox CJ, Moore EE. The role of REBOA in the control of exsanguinating torso hemorrhage: J Trauma Acute Care Surg 2015;78(5):1054–8.
- Joint Trauma System, Damage Control Resuscitation CPG, 12 Jul 2019; https://jts.health.mil/index.cfm/PI_CPGs/cpgs Accessed Mar 2020.
- Teeter WA, Bradley MJ, Romagnoli A, et al. Treatment effect or effective treatment? Cardiac compression fraction and end-tidal carbon dioxide are higher in patients with resuscitative endovascular balloon occlusion of the aorta compared with resuscitative thoracotomy and open- chest cardiac massage. Am Surg. 2018 Oct 1;84(10):1691-1695.
- Stannard A, Eliason JL, Rasmussen TE. Resuscitative endovascular balloon occlusion of the aorta (REBOA) as an adjunct for hemorrhagic shock. J Trauma 2011;71(6):1869–72.
- Tibbits EM, Hoareau GL, Simon MA, et al. Location is everything: the hemodynamic effects of REBOA in zone 1 versus zone 3 of the aorta. J Trauma Acute Care Surg. 2018;85(1):101–107.
- Reva VA, Matsumura Y, Hörer T, et al. Resuscitative endovascular balloon occlusion of the aorta: what is the optimum occlusion time in an ovine model of hemorrhagic shock? Eur J Trauma Emerg Surg. 2018 Aug;44(4):511-518.
- Bekdache O, Paradis T, Shen YBH, et al. Resuscitative endovascular balloon occlusion of the aorta (REBOA): indications: advantages and challenges of implementation in traumatic non-compressible torso hemorrhage. Trauma Surgery & Acute Care Open 2019;4:e000262.
- Kauvar DS, Dubick MA, Martin MJ. Large animal models of proximal aortic balloon occlusion in traumatic hemorrhage: review and identification of knowledge gaps relevant to expanded use. J Surg Res 2019;236:247–58.
- Villamaria CY, Eliason JL, Napolitano LM, et al. Endovascular Skills for Trauma and Resuscitative Surgery (ESTARS) course: curriculum development, content validation, and program assessment. J Trauma Acute Care Surg 2014;76(4):929–35; discussion 935–6.
- Brenner M, Hoehn M, Pasley J, et al. Basic endovascular skills for trauma course: bridging the gap between endovascular techniques and the acute care surgeon. J Trauma Acute Care Surg 2014;77(2):286–91.
- Brenner M, Hoehn M, Stein DM, et al. Central pressurized cadaver model (CPCM) for resuscitative endovascular balloon occlusion of the aorta (REBOA) training and device testing. J Trauma Acute Care Surg 2015;78(1):197–200.
- Glaser JJ, Fisher AD, Shackelford SA, Butler F, Rasmussen TE. A contemporary report on U.S. military guidelines for the use of whole blood and resuscitative endovascular balloon occlusion of the aorta. J Trauma Acute Care Surg. 2019 Jul;87
- Morrison JJ, Ross JD, Rasmussen TE, et al. Resuscitative endovascular balloon occlusion of the aorta: a gap analysis of severely injured UK combat casualties. Shock 2014;41(5):388–93.
- Pasley JD, Teeter WA, Gamble WB, et al. Bringing Resuscitative Endovascular Balloon Occlusion of the Aorta (REBOA) Closer to the Point of Injury. J Spec Oper Med. 2018 Spring;18(1):33-36.
- Saito N, Matsumoto H, Yagi T, et al. Evaluation of the safety and feasibility of resuscitative endovascular balloon occlusion of the aorta. J Trauma Acute Care Surg 2015;78(5):897–903; discussion 904.
- Simon MA, Tibbits EM, Hoareau GL, et al. Lower extremity cooling reduces ischemia-reperfusion injury following Zone 3 REBOA in a porcine hemorrhage model. J Trauma Acute Care Surg. 2018 Sep;85(3):512-518.
- Williams AM, Bhatti UF, Dennahy IS, Graham NJ, Nikolian VC, Chtraklin K, Chang P, Zhou J, Biesterveld BE, Eliason J, Alam HB. Traumatic brain injury may worsen clinical outcomes after prolonged partial resuscitative endovascular balloon occlusion of the aorta in severe hemorrhagic shock model. Journal of Trauma and Acute Care Surgery. 2019 Mar 1;86(3):415-23.
Додаток А. Алгоритм дій при травматичній зупинці серця
Невідкладна оклюзія аорти (ROA): алгоритм дій при травматичній зупинці серця
- Тупа травма без значної кровотечі в грудній клітці, підтверджена виконанням рентгенографії, УЗД або у результаті встановлення плевральних дренажів з обох боків.
- Проникаюче поранення черевної порожнини / таза
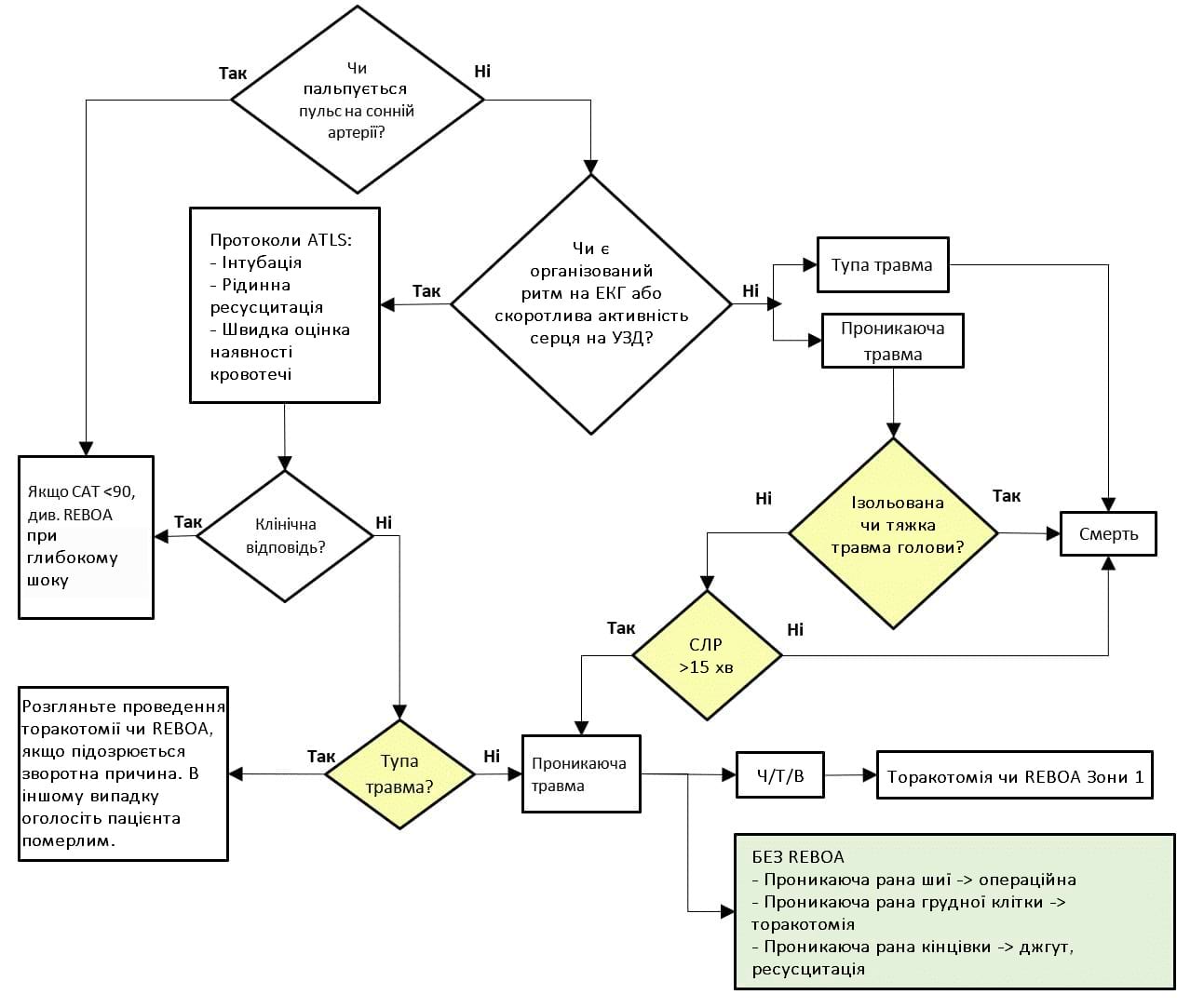
REBOA: Resuscitative Endovascular Balloon Occlusion of the Aorta - невідкладна ендоваскулярна балонна оклюзія аорти; EFAST: Extended Focused Assessment with Sonography for Trauma - розширена фокусована сонографічна оцінка при травмах; ATLS: Advanced Trauma Life Support - Розширена підтримка життя при травмах; ЕКГ: Електрокардіографія; САТ: Систолічний артеріальний тиск; СЛР: серцево-легенева реанімація; Ч/Т/В: черевна порожнина /таз /вузлова зона (в ділянці з’єднання таза і нижніх кінцівок)
REBOA в зоні 1: розміщення аортального балона в грудній аорті (введіть катетер на довжину 46 см або відміряйте відстань балоном до середини грудини, або P-наконечником до яремної ямки)
REBOA в зоні 3: розміщення аортального балона безпосередньо над біфуркацією аорти (введіть катетер на довжину 27 см, або відміряйте відстань балоном до пупка, або P-наконечником до мечоподібного відростка).
Додаток B. Алгоритм застосування REBOA для лікування глибокого шоку
САТ<90 з нестійкою або відсутньою відповіддю на початкову ресусцитацію за принципами ATLS
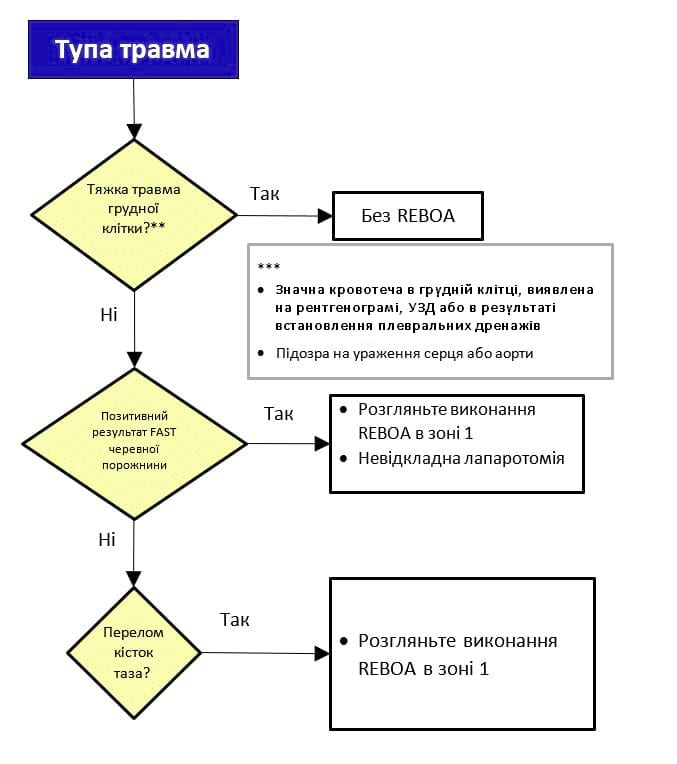
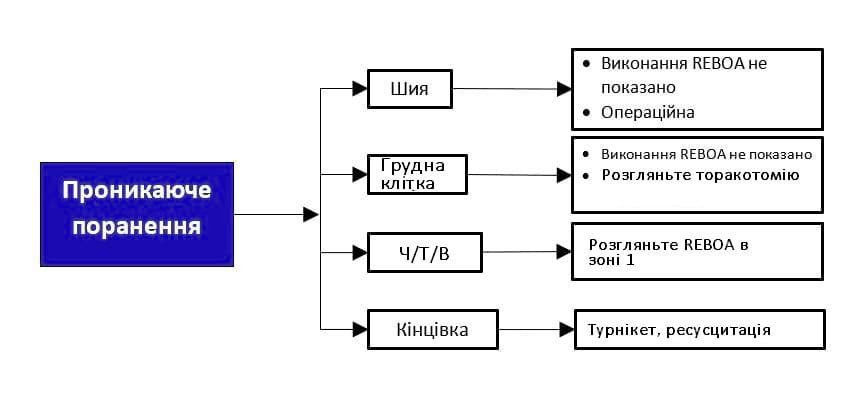
REBOA: Resuscitative Endovascular Balloon Occlusion of the Aorta - невідкладна ендоваскулярна балонна оклюзія аорти; EFAST: Extended Focused Assessment with Sonography for Trauma - розширена фокусована сонографічна оцінка при травмах; ATLS: Advanced Trauma Life Support - Розширена підтримка життя при травмах; ЕКГ: Електрокардіографія; САТ: Систолічний артеріальний тиск; СЛР: серцево-легенева реанімація; Ч/Т/В: черевна порожнина /таз /вузлова зона (в ділянці з’єднання таза і нижніх кінцівок)
REBOA в зоні 1: розміщення аортального балона в грудній аорті (введіть катетер на довжину 46 см або відміряйте відстань балоном до середини грудини, або P-наконечником до яремної ямки)
REBOA в зоні 3: розміщення аортального балона безпосередньо над біфуркацією аорти (введіть катетер на довжину 27 см, або відміряйте відстань балоном до пупка, або P-наконечником до мечоподібного відростка).
Додаток C. Зони аорти
Додаток D. Обладнання й витратні матеріали для REBOA
- УЗД (лінійний датчик для судинного доступу)
- Хірургічний набір для відкритого доступу на стегновій артерії, включаючи самоутримувальні ретрактори
- Скальпель (№ 11 або № 15)
- Набір для мікропункції 5 Fr або набір для артеріального доступу з катетером 18 Ga (наприклад, Cook Medical G43870, NSN 6515016591707; або Vascular Solutions, Inc 7208V; або Arrow Femoral Arterial Line UM-04018)
- Артеріальний інтрод`юсер 7 Fr (наприклад, набір ER REBOA Catheter Introducer kit, Prytime Medical KT1835C; або Cordis Avanti 402-607x, NSN 6515016594864)
- Катетер ER REBOA (Prytime Medical, NSN 6515016580745)
- Пристрій для фіксації центрального катетера
- Шовний матеріал та шовкові нитки
- Триходовий інфузійний кран
- Шприц 30 мл з перехідником Люер-лок
- Попередньо заповнений фізіологічним розчином шприц (об’єм 10 мл, 3 шт)
- Фізіологічний розчин для ін'єкцій (100 мл)
- Додатково: Контрастна речовина для ВВ введення (змішати 8 мл у 16 мл фізіологічного розчину для наповнення балона)
- Стандартний набір для артеріального доступу; або пристрій Compass
- Якщо є можливість забезпечення стерильності: стерильний чохол для ультразвукового датчика, хірургічні серветки для покриття всього тіла та операційного поля, засоби для дезінфекції (підготовки персоналу до процедури)
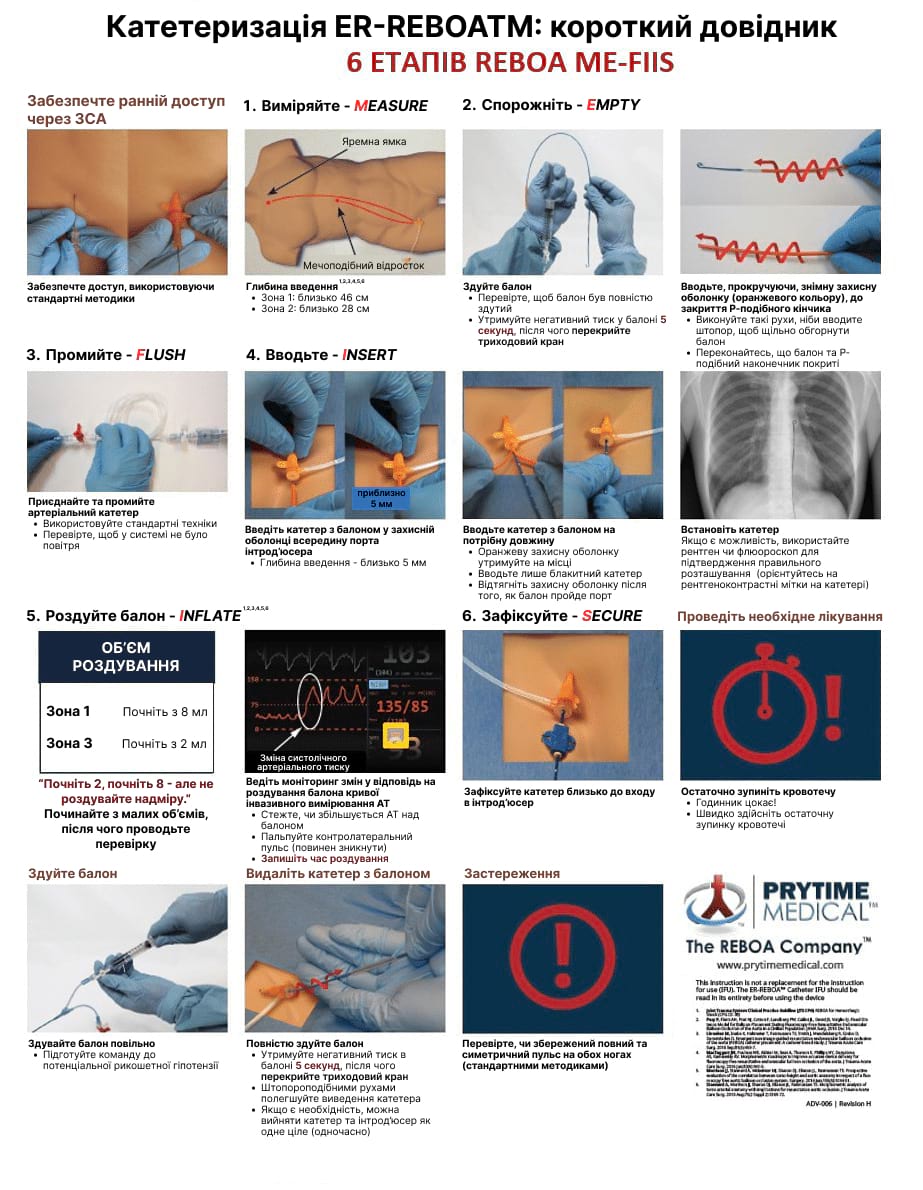
Додаток E. Етапи виконання REBOA із використанням 7 French ER-REBOA
Процедуру можна переглянути онлайн за такими посиланнями:
Частина 1: https://www.youtube.com/watch?v=-U7MkU3eA7E
Частина 2: https://www.youtube.com/watch?v=DZ5LCEt7PBk
Етап 1. Артеріальний доступ та розміщення інтрод’юсера
Встановлення артеріального доступу:
Доступ до артеріального кровообігу у випадку проведення REBOA при травмі слід отримати через загальну стегнову артерію за допомогою однієї з трьох методик: черезшкірний доступ, відкритий доступ (наприклад, розріз) або по провіднику замінюючи вже встановлений в ЗСА артеріальний катетер.
Для ідентифікації загальної стегнової артерії (вище/проксимальніше відходження глибокої артерії стегна) та візуалізації проходження в неї голки використовується УЗД (перевага надається лінійному датчику).
Ультразвуковий контроль підвищує успіх виконання з першого разу і зменшує кількість ускладнень.1 Після ідентифікації артерії голку слід ввести під кутом 45 градусів, використовуючи або набір для мікропункції 5 Fr, або набір для катетеризації стегнової артерії 18 G. Після того, як провідник уведено в артерію, голку виймають, роблять невеликий надріз у місці контакту провідника зі шкірою і проводять катетер через провідник.
За допомогою анатомічних орієнтирів визначають розташування пахової зв’язки між передньо-верхньою клубовою остю і лобковим симфізом (НЕ паховою складкою). Після цього виконують доступ до загальної стегнової артерії на 2 см нижче від пахової зв’язки.
Вибір і розташування початкового інтродюсера:
Якщо є показання для REBOA, артеріальний катетер слід замінити на інтрод’юсер 7 Fr. Цей маневр виконується шляхом введення через внутрішній просвіт артеріального катетера 0,035-дюймового провідника, довжина якого вдвічі більша за довжину встановленого артеріального катетера, що дозволяє вийняти катетер через провідник, зберігаючи при цьому артеріальний доступ. Після створення більшого отвору в місці контакту провідника і шкіри “робочий” інтрод’юсер 7 Fr зі встановленим внутрішнім розширювачем можна ввести поверх провідника. Якщо ситуація ургентна, можна одразу вводити інтрод’юсер 7 Fr по 0,035-дюймовому провіднику (без розширення отвору), хоча це може підвищити ризик пошкодження місця доступу.
Внутрішній розширювач інтрод’юсера має бути міцно зафіксований для забезпечення плавного розширення просвіту судини від діаметра провідника до діаметра інтрод’юсера та уникнення пошкодження інтими артерії. Після того, як розширювач та інтродюсер введені поверх провідника через шкіру в артерію, розширювач і провідник виймають, залишаючи інтрод’юсер на місці. Важливо, щоб оператор, який виконує процедуру, переконався, що триходовий кран перебуває в положенні «вимкнено», щоб зменшити кровотечу.
Етап 2. Вибір і розташування балона
Вибір балона:
ER REBOA (Prytime Medical, New Braunfels, TX) — це єдиний пристрій для REBOA, який описаний у цих настановах, оскільки саме його обрало Міністерство оборони США. Цей балон не передбачає використання провідника і флюороскопії, а також має менший калібр, ніж раніше використовувані балони, що дозволяє виконувати менше етапів для введення і використовувати менший інтрод’юсер (7 Fr). Він також має функцію моніторингу артеріального тиску.
Підготовка балона:
Приєднайте шприц об’ємом 30 мл до порту балона ER-REBOA. Шприц слід заповнити 24 мл рідини, що на 1/3 складається з контрастної речовини та на 2/3 — з фізіологічного розчину, або тільки фізіологічним розчином, якщо контрастна речовина недоступна. Слід злегка відтягнути шприцом повітря з балона, щоб створити у ньому негативний тиск і таким чином видалити залишки повітря, а потім зафіксувати поршень на позначці 30 мл (на шприці).
Артеріальний катетер слід промити фізіологічним розчином. Тепер балон легко ввійде в знімну захисну оболонку.
Якщо ви використовуєте функцію моніторингу тиску, датчик тиску і трубки слід приєднати до триходового інфузійного крана на катетері і промити фізіологічним розчином, використовуючи стандартний набір для артеріального доступу і датчик, підключений до монітора. Після введення катетера необхідно постійно стежити за тим, щоб не допустити випадкової емболії (повітря, тромб тощо), а також за тим, щоб зберегти прохідність магістралей артеріального доступу.
Розташування балона:
Для оклюзії Зони 1 катетер слід ввести на 46 см (або виміряти відстань від балона, розташованого на середині грудини, або Р-наконечника в яремній ямці, - до стегнового артеріального катетера). Для оклюзії Зони 3 катетер слід ввести на 28 см (або виміряти відстань від балона, розташованого на рівні пупка, або Р-наконечника на рівні мечоподібного відростка, - до стегнового артеріального катетера). Відстані позначені на стрижні катетера.
Знімну захисну оболонку (оранжевого кольору) просувають поверх P-наконечника і балона, щоб захистити їх при вході в інтрод`юсер 7F. Захисну оболонку просувають в інтрод`юсер 7F приблизно на 5 мм або до досягнення позначки stop. Далі, катетер REBOA просувають в інтрод`юсер на 10 см. Після цього захисну оболонку можна знову відтягнути до порта катетера або вийняти, якщо вимагається введення на повну довжину. Катетер слід вводити на заздалегідь визначену глибину. Оглядова рентгенографія, УЗД або флюороскопія можуть підтвердити правильне розташування катетера, і, за необхідності, його можна відкоригувати перед роздуванням балона. На катетер нанесено дві рентгеноконтрастні мітки для позначення місця розташування балона. У разі зупинки серця немає необхідності підтверджувати розташування балона; це можна зробити пізніше, коли стан пацієнта буде стабільним.
Етап 3. Роздування балона, фіксація пристрою та моніторинг
Роздування балона:
Слід використовувати шприц об’ємом 30 мл. Заповніть шприц 24 мл рідини, що на 1/3 складається з йодовмісної контрастної речовини та на 2/3 — з фізіологічного розчину, або тільки фізіологічним розчином, якщо контрастна речовина недоступна.2 Балон слід роздувати до підвищення артеріального тиску та зникнення пульсу на протилежній стегновій артерії, приблизно 8 мл для Зони 1; 2 мл для Зони 3.
Не роздувайте балон надміру; ємність балона становить 24 мл — надмірне роздування може призвести до розриву балона або пошкодження аорти. При роздуванні балона можна орієнтуватися на дані флюороскопії, гемодинамічну реакцію та (або) зникнення пульсу на протилежній кінцівці. Якщо флюороскопія доступна, роздувайте балон доти, доки зовнішні краї балона не зміняться з опуклих на паралельні в міру того, як балон прийматиме форму/контур стінок аорти. Коли об’єм балона виглядатиме достатнім для прилягання до стінок аорти та/або підвищиться центральний артеріальний тиск, канал триходового інфузійного крана до балона слід перекрити, щоб підтримувати балон в роздутому стані та забезпечувати оклюзію, поки проводяться інші маніпуляції. Для підтвердження місця розташування балона можна використати рентгенографію. Якщо в непристосованому середовищі з обмеженим забезпеченням візуалізаційні методи досліджень відсутні, остаточне підтвердження позиціонування балона слід виконати безпосередньо вручну під час лапаротомії. Якщо буде виявлено, що балон розташований неправильно (наприклад, у Зоні 2), його можна здути, встановити катетер у Зону 1 або 3 і повторно роздути балон.
Фіксація роздутого балона та інтрод’юсера:
Коли центральний тиск в аорті підвищується, існує ризик зміщення катетера в каудальному напрямку. Щоб запобігти міграції катетера, УТРИМУЙТЕ катетер на місці або зафіксуйте катетер на інтрод’юсері, а інтрод’юсер на пацієнті за допомогою пристрою для фіксації центрального венозного катетера. Для додаткового контролю та безпеки доручіть асистенту утримувати пристрій, поки не буде досягнуто бажаного рівня здуття балона.
Передопераційна підготовка пацієнта:
Асистент з відповідними навичками повинен контролювати і повідомляти «велику трійку» факторів, необхідних для успішного виконання REBOA: середній артеріальний тиск, забезпечення належного положення катетера і підтримання оклюзії (роздування балона).
Середній артеріальний тиск: Відразу після роздування балона та успішної оклюзії аорти середній артеріальний тиск підвищується. Щоб запобігти негативним наслідкам збільшення об'єму циркулюючої крові, що призводить до гіпертензії, лікар повинен розглянути можливість часткової аортальної оклюзії, якщо середній артеріальний тиск перевищує 100. Необхідно стежити за змінами на хвилеподібній кривій інвазивного моніторингу АТ, включаючи надмірне згасання (сплощена крива) або недостатнє згасання (гіпердинамічна крива). Слід вжити заходів для попередження виникнення проблем у функціонуванні датчика та відповідних артеріальних магістралей. Система моніторингу тиску має включати спеціальну трубку для вимірювання тиску, попередньо заповнену, з видаленим повітрям, не надмірної довжини і з мінімальним використанням триходових інфузійних кранів. Переконайтеся, що всі з'єднання міцні, але не затягуйте їх занадто.
Положення катетера: Медик повинен часто перевіряти виміряну відстань катетера на інтродюсері, щоб переконатися, що катетер не зміщується. Повідомте лікаря, якщо відбулося зміщення катетера.
Підтримання оклюзії: Потрібно часто контролювати пульс на кінцівках. Якщо пульс присутній, а часткова REBOA не передбачена, то балонна оклюзія не досягнута і має бути скоригована. Повідомте лікаря про необхідність додати в балон 0,5 мл фізіологічного розчину і повторно перевірте середній артеріальний тиск і дистальний пульс на кінцівках, щоб переконатися в наявності повної оклюзії.
Етап 4. Оперативна / процедурна зупинка кровотечі
Зупинку кровотечі нижче діафрагми слід виконати дуже швидко, щоб загальний час оклюзії аорти не перевищував 30 хвилин. Тому важливо почати з втручань контролю критичних пошкоджень (демедж-контролю) для зупинки кровотечі, таких як затискання ворітних судин селезінки або нирок, маневру Прінгла, затискання усіх пошкоджених кровоносних судин, тампонування або отримання проксимального і дистального контролю над пошкодженою кровоносною судиною. Іноді остаточну зупинку кровотечі, наприклад, шляхом видалення паренхіматозного органа, перев'язування затиснутих судин або встановлення судинного шунта, можна відкласти, доки балон REBOA не буде здутий.
У пацієнтів з переломами кісток таза можна розглянути інтервенційну радіологічну емболізацію, якщо вона доступна. Зробити це можна після виключення або зупинки внутрішньочеревної кровотечі та встановлення REBOA в Зоні 3.
Етап 5. Здування балона
Балон слід здути, як тільки буде виконано зупинку кровотечі. Комунікація з асистентом, який фіксує катетер, та анестезіологічною бригадою має вирішальне значення перед здуванням балона. Під час здування балона поверніть триходовий інфузійний кран та відтягніть шприцом фізіологічний розчин повільно, оскільки цей етап потенційно може призвести до значної гіпотензії, що може спричинити серцевий колапс. Під час здування балона може знадобитися подальше проведення невідкладних заходів. Поки одна особа зосереджується на повільному здуванні балона, інша повинна утримувати катетер та інтрод’юсер в такому положенні, щоб уникнути ненавмисного зміщення, тому що може виникнути потреба швидко роздути балон повторно. Після здування балона команда повинна враховувати можливі гемодинамічні зміни, пов'язані з реперфузією, вимиванням продуктів метаболізму та ацидозом. Враховуючи це, у ході ресусцитації може знадобитися періодичне роздування та здування балона, поки не відновиться гемодинамічна стабільність.
Етап 6. Видалення балона та інтрод’юсера
Після того, як потреба в REBOA зникає, балон можна здути. Критично важливим є підтримка тісної комунікації з анестезіологічною бригадою, щоб враховувати можливість виникнення транзиторної гіпотензії під час здування балона. Після остаточної зупинки кровотечі інтрод’юсер REBOA слід вийняти і притиснути місце доступу до ЗСА на 30 хвилин.
Найкращою практикою, хоча і не завжди доступною, є проведення ангіографії через інтрод’юсер для документування перфузії дистальних відділів кінцівок. Аортограму найкраще виконувати в закладі 3 етапу із доступом до вузьких спеціалістів та/або хірургічних ресурсів.
Інтрод’юсер не слід видаляти безпосередньо перед транспортуванням; найкраще видаляти інтрод’юсер в закладі, де існує можливість лікування та контролю судинних ускладнень. Якщо очікуваний час транспортування пацієнта становить менше 4 годин, інтрод`юсер може залишатися на місці у пацієнтів з високим ризиком повторної кровотечі / продовження кровотечі. Якщо час транспортування пацієнта перевищує 4 години, інтрод`юсер слід зняти щонайменше за 30 хвилин до транспортування, щоб забезпечити достатній гемостаз у місці пункції ЗСА. За такими пацієнтами слід ретельно спостерігати під час транспортування, щоб виявити ознаки ускладнень у ділянці доступу. Поки інтрод’юсер на місці, а також у межах 24 годин після його видалення пацієнту слід щогодини проводити перевірку стану судин та нервів обох нижніх кінцівок. У разі виникнення відхилень від норми лікарі повинні без зайвих зволікань залучати судинних хірургів або виконувати артеріограму нижніх кінцівок.
Нагадаємо знову, ЗАБОРОНЯЄТЬСЯ залишати інтрод’юсер при передачі пацієнта в медичний заклад країни, на території якої відбувається військовий конфлікт.
Якщо використовується інтрод’юсер великого розміру, у пацієнта розвивається коагулопатія або виникають технічні труднощі із видаленням інтрод’юсера, може знадобитися відкрита реконструкція судин. Якщо необхідно виконати відкриту хірургічну реконструкцію місця артеріального доступу, слід розкрити стегнову артерію проксимальніше і дистальніше місця входу інтрод’юсера, щоб забезпечити візуальний контроль. Для цього може вимагатися розріз на 2–3 см проксимальніше, під паховою зв'язкою; асистент має використовувати вузький ручний ретрактор (наприклад, короткий ретрактор для ниркової вени Wylie), щоб припідняти пахову зв'язку над стегновим каналом. Розкриття дистальніше місця входу інтрод’юсера часто вимагає ідентифікації та контролю (перетискання/лігації) як поверхневих, так і глибоких стегнових артерій.
Після виконання проксимального і дистального розкриття та контролю за допомогою судинних петель або судинних затискачів інтрод’юсер можна вийняти. Слід розглянути можливість проведення катетерів для емболектомії дистальніше, щоб видалити будь-який потенційний тромб і забезпечити зворотний кровотік. Отриману внаслідок артеріотомії ділянку судини, особливо в області інтими, слід ретельно оглянути і, за необхідності, “відкоригувати” ножицями Поттса, щоб забезпечити первинне поперечне закриття. Закриття після артеріотомії слід виконувати в поперечному напрямку монофіламентною ниткою 5-0 або 6-0 переривчастим (одиночним) або безперервним швом, стежачи за тим, щоб захопити всі шари артеріальної стінки при проходженні голки. Перед накладанням останнього шва слід відновити кровоплин в сегментах артерії дистальніше і проксимальніше місця артеріотомії з подальшим промиванням поверхні гепаринізованим фізіологічним розчином. Відновлення кровоплину в сегменті артерії слід підтвердити за допомогою ручної пальпації пульсу дистальніше та доплерівського дослідження як стегнової артерії, так і судин дистального відділу кінцівки. У разі виникнення сумнівів щодо повноцінності кровоплину рекомендується виконати ангіограму та провести відповідне втручання, якщо будуть виявлені будь-які відхилення. Закриття м'яких тканин над стегновою артерією виконується пошарово з використанням розсмоктувального шовного матеріалу в м'яких тканинах.
Джерела:
- Marquis-Gravel G1, Tremblay-Gravel M1, Lévesque J1, Généreux P1,2,3, Schampaert E1, Palisaitis D1, Doucet M1, Charron T1, Terriault P1, Tessier P1. Ultrasound guidance versus anatomical landmark approach for femoral artery access in coronary angiography: A randomized controlled trial and a meta-analysis. J Interv Cardiol. 2018 Aug;31(4):496-503. doi: 10.1111/joic.12492. Epub 2018 Jan 25.
- Курс «Базові ендоваскулярні навички при травмі» (Basic Endovascular Skills for Trauma, BEST) Американської колегії хірургів https://www.facs.org/quality-programs/trauma/education/best
Додаток F. Контрольний список процедури ER-REBOA
- Проводьте ресусцитацію згідно з принципами ATLS (Advanced Trauma Life Support - Розширена підтримка життя при травмі)
- Виключіть тяжку торакальну травму (рентгенограма органів грудної клітки / EFAST / двобічне встановлення плевральних дренажів)
- Підтвердіть причину шоку - травму та кровотечу - в черевній порожнині чи порожнині таза (FAST та рентген таза при тупій травмі)
- Підтвердіть наявність пульсу на стегнових артеріях обох кінцівок
- Встановіть артеріальний доступ за допомогою інтрод’юсера 7 Fr через неушкоджену загальну стегнову артерію
- Виміряйте відстань для введення балона
- Спорожніть балон (створіть негативний тиск)
- Промийте артеріальний катетер
- Введіть катетер REBOA
- Роздуйте балон (Зона 1: почніть з 8 мл; Зона 3: почніть з 2 мл)
- Зафіксуйте катетер
- Зупиніть значну кровотечу
- Спостерігайте за загальним станом пацієнта, гемодинамікою, положенням катетера з балоном та інтрод’юсера
- Проведіть належні невідкладні заходи та здуйте балон
- Завершіть хірургічні втручання з контролем критичних пошкоджень
- Вийміть інтрод’юсер після корекції коагулопатії
- Перевірте дистальний пульс на кінцівках після видалення інтрод’юсера
Додаток G. ER REBOA: Короткий довідник
Відмова від відповідальності (дисклеймер): JTS не спонукає до використання конкретного катетера чи обладнання певної торгової марки для виконання REBOA. Мета цієї короткої довідки — навчити лікарів правильному використанню катетера для покращення клінічної допомоги.
Додаток H. Протокол процедури оклюзії аорти

Додаток I. Додаткова інформація щодо не передбаченого інструкцією застосування лікарських засобів у настановах з клінічної практики
Мета
Мета цього Додатка — надати роз’яснення політики та практики Міністерства оборони США щодо включення в Настанови з клінічної практики «незатверджених» показань для продуктів, які були схвалені Управлінням з контролю якості продуктів харчування і лікарських засобів США (FDA). Це стосується використання препаратів не за призначенням для пацієнтів, які належать до Збройних сил США.
Вихідна інформація
Незатверджене (тобто «не за призначенням» - “off-label”) використання продуктів, схвалених FDA, надзвичайно поширене в медицині США і зазвичай не регулюється окремими нормативними актами. Проте, згідно з Федеральним законодавством, за деяких обставин застосування схвалених лікарських засобів за незатвердженими показаннями регулюється положеннями FDA про «досліджувані нові ліки». До цих обставин належить використання в рамках клінічних досліджень, а також, у військовому контексті, використання за незатвердженими показаннями згідно з вимогами командування. Деякі види використання за незатвердженими показаннями також можуть підлягати окремим нормативним актам.
Додаткова інформація щодо застосування за незатвердженими показаннями у настановах з клінічної практики
Включення до Настанов з клінічної практики використання медикаментів за незатвердженими показаннями не належить до клінічних випробувань і не є вимогою командування. Більше того, таке включення не передбачає, що Військова система охорони здоров’я вимагає від медичних працівників, які працюють в структурах Міноборони США, застосовувати відповідні продукти за незатвердженими показаннями або вважає це «стандартом медичної допомоги». Швидше, включення до CPGs використання засобів «не за призначенням» має поглиблювати клінічне судження відповідального медичного працівника шляхом надання інформації щодо потенційних ризиків та переваг альтернативного лікування. Рішення приймається на основі клінічного судження відповідальним медичним працівником у контексті відносин між лікарем і пацієнтом.
Додаткові процедури
Виважений розгляд
Відповідно до цієї мети, в обговореннях використання медикаментів «не за призначенням» в CPG конкретно зазначено, що це використання, яке не схвалено FDA. Крім того, такі обговорення є збалансованими у представленні даних клінічних досліджень, включаючи будь-які дані, які свідчать про обережність у використанні продукту, і, зокрема, включаючи усі попередження, видані FDA.
Моніторинг забезпечення якості
Що стосується використання «не за призначенням», діяльність Міністерства оборони США полягає у підтримці регулярної системи моніторингу забезпечення якості результатів і відомих потенційних побічних ефектів. З цієї причини підкреслюється важливість ведення точних клінічних записів.
Інформація для пацієнтів
Належна клінічна практика передбачає надання відповідної інформації пацієнтам. У кожних Настановах з клінічної практики, де йдеться про використання засобу «не за призначенням», розглядається питання інформування пацієнтів. За умови практичної доцільності, слід розглянути можливість включення додатка з інформаційним листком для пацієнтів, що видаватиметься до або після застосування продукту. Інформаційний листок має в доступній для пацієнтів формі повідомляти наступне: a) що дане застосування не схвалене FDA; b) причини, чому медичний працівник Міністерства оборони США може прийняти рішення використати продукт з цією метою; c) потенційні ризики, пов’язані з таким застосуванням.


























