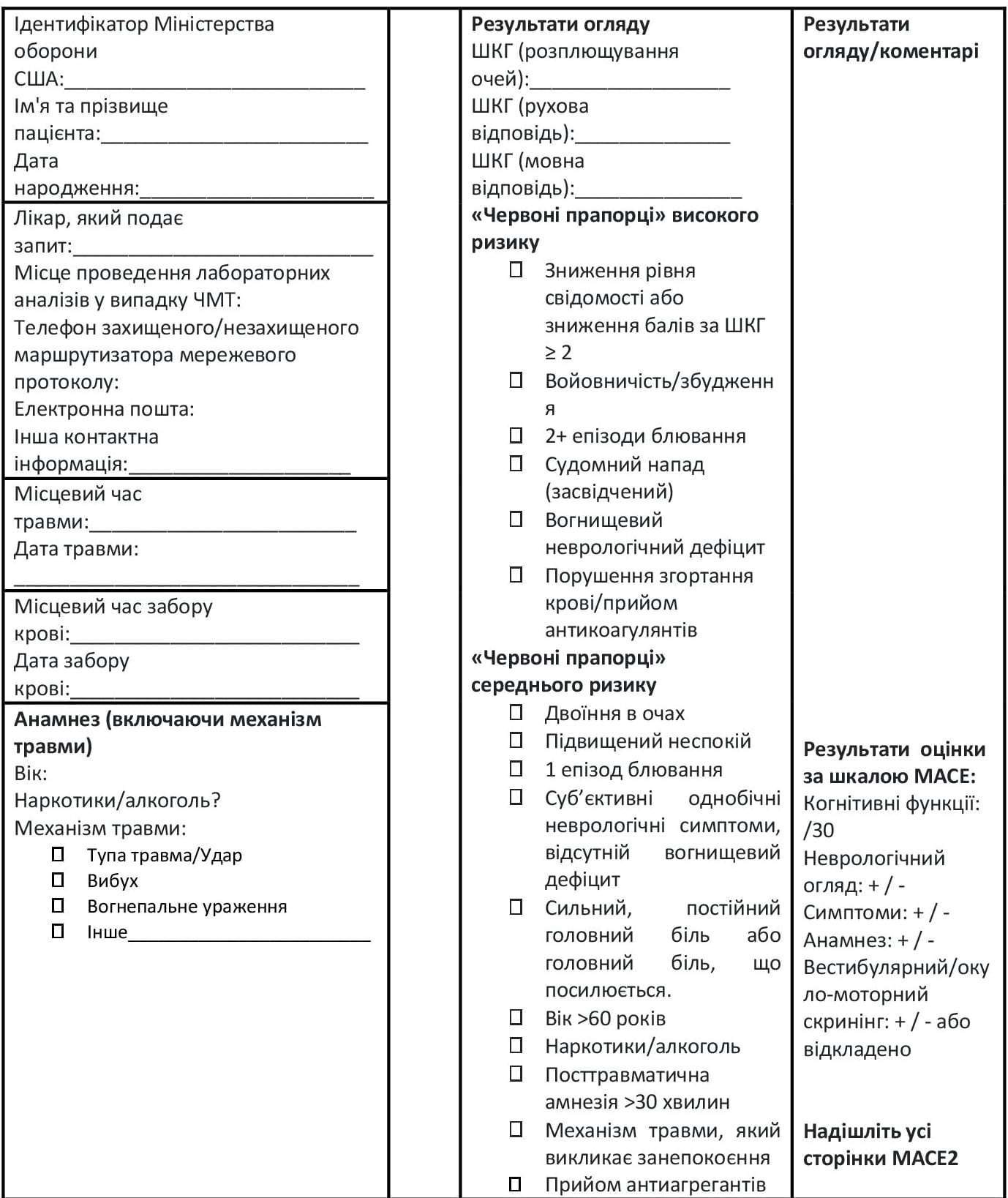
Мета
Ці настанови призначені для забезпечення базового підходу до лікування постраждалих після події, що потенційно може спричинити струс головного мозку, з використанням специфічних плазмових біомаркерів черепно-мозкової травми (ЧМТ), визначених на аналізаторі крові iSTAT Alinity. Ці настанови не стосуються інших пристроїв, що використовуються при травмах головного мозку, або біомаркерів ЧМТ. Дані настанови з клінічної практики призначені для доповнення та побудовані на основі існуючої інструкції 6490.11 Міністерства оборони США щодо лікування легкої ЧМТ/струсу головного мозку в умовах бойових дій.
Вихідна інформація
- У період з 2000 по 2019 рік ЧМТ отримали понад 417 503 військовослужбовців у всьому світі, причому 88% цих травм були класифіковані як легкі (лЧМТ), також відомі як струс головного мозку.1 До поширених наслідків лЧМТ відносяться: головний біль, порушення зору, посттравматичний стресовий розлад (ПТСР), депресія та когнітивні розлади; особи з легкою ЧМТ мають підвищений ризик розвитку ПТСР.2-4 Виходячи з цього, лише 70% осіб з діагностованою лЧМТ повертаються до повноцінної служби.5
- Особи з легкою ЧМТ зазвичай мають нормальний (або “негативний”) результат комп'ютерної томографії (КТ) голови. Метою проведення даного дослідження в особи з підозрою на лЧМТ є виключення більш серйозної травми, яка потребує вищого рівня надання допомоги. Наприклад, внутрішньочерепний крововилив потребує стаціонарного спостереження, а у важких випадках — нейрохірургічного втручання. У цивільних умовах приблизно 6-8% осіб з підозрою на легку ЧМТ при первинному обстеженні мають ознаки внутрішньочерепного крововиливу, а 1-2% потребують нейрохірургічного втручання.6,7
- Комп’ютерні томографи зазвичай доступні в театрі бойових дій у закладах третього етапу надання допомоги, а також у деяких удосконалених закладах другого етапу надання допомоги. Рішення транспортувати пораненого з першого або другого етапу на третій етап для проведення КТ голови може мати значні наслідки щодо безпеки екіпажу літака/вертольота та виконання бойового завдання. Прийняття медичних рішень має включати оцінку ризиків виконання завдань.
- Оцінка Реєстру травм Міністерства оборони США (DoDTR) свідчить про те, що 68% поранених, у яких ідентифіковано легку ЧМТ, було евакуйовано на третій етап надання допомоги для проведення КТ голови та 41% - на четвертий етап, при цьому приблизно 78% цих солдатів повернулися до служби.8 Однак, важливо пам’ятати, що цей реєстр містить лише підгрупу більш тяжко поранених військовослужбовців із лЧМТ у зоні бойових дій. Тим не менше, дані свідчать про те, що можна уникнути багатьох евакуацій для проведення КТ голови.
- Військова шкала оцінки струсу мозку 2 (MACE2) містить настанови щодо первинної оцінки та лікування осіб із 13-15 балами за шкалою ком Глазго (ШКГ) в умовах бойових дій. Вона включає оцінку наявності «червоних прапорців» для визначення необхідності проведення КТ голови та евакуації. Крім того, Новоорлеанські Критерії (New Orleans Criteria) та Канадські правила проведення КТ голови (Canadian Head CT rule) також допомагають визначити осіб, яким, швидше за все, дане дослідження буде корисним. Жоден з цих критеріїв не був перевірений в умовах розгорнутих бойових дій.9,10
- Гліальний фібрилярний кислий протеїн (GFAP) та убіквітинова карбокситермінальна гідролаза L1 (UCH-L1) містяться в клітинах центральної нервової системи та вивільняються при пошкодженні нейронів. Підвищені рівні цих речовин вказують на прогресування пошкодження нейронів.
- У січні 2021 року Управління по контролю якості харчових продуктів та лікарських засобів (FDA) США схвалило плазмові біомаркери ЧМТ — спеціальний картридж i-STAT для випадків ЧМТ із системою i-STAT Alinity. Цей напівкількісний аналіз визначає рівні GFAP і UCH-L1 у плазмі. Медичний заклад із лабораторією може проводити тестування для виявлення біомаркерів ЧМТ у плазмі постраждалих. Результат тесту “не підвищений” має майже 100% прогностичну значущість негативного результату щодо визначення відсутності гострих травматичних внутрішньочерепних ушкоджень голови. КТ-візуалізація. (Для додаткової інформації див. Додаток С, Мал. 1.) Це дослідження також відоме як система аналізатора ЧМТ (ATBI).
- Оскільки для визначення біомаркерів ЧМТ використовується плазма, тестування можна проводити лише в умовах клінічної лабораторії з можливістю виготовлення та дослідження зразка плазми. Основні матеріально-технічні вимоги включають центрифугу, холодильник для зберігання картриджів і морозильну камеру для калібрувальної рідини. Поточні зусилля щодо розробки та вдосконалення тесту зосереджені на тому, аби зробити можливим його виконання, використовуючи цільну кров, що розширить використання біомаркерів у різних середовищах.
ПРИМІТКА: Пов'язані настанови з клінічної практики: Настанови з клінічної практики Міністерства у справах ветеранів США/Міністерства оборони США «Лікування струсу головного мозку/легкої черепно-мозкової травми», настанови Об’єднаної системи лікування травм «Нейрохірургія і тяжка травма голови».
Структура, направлена на підтримку оптимального використання біомаркерів ЧМТ
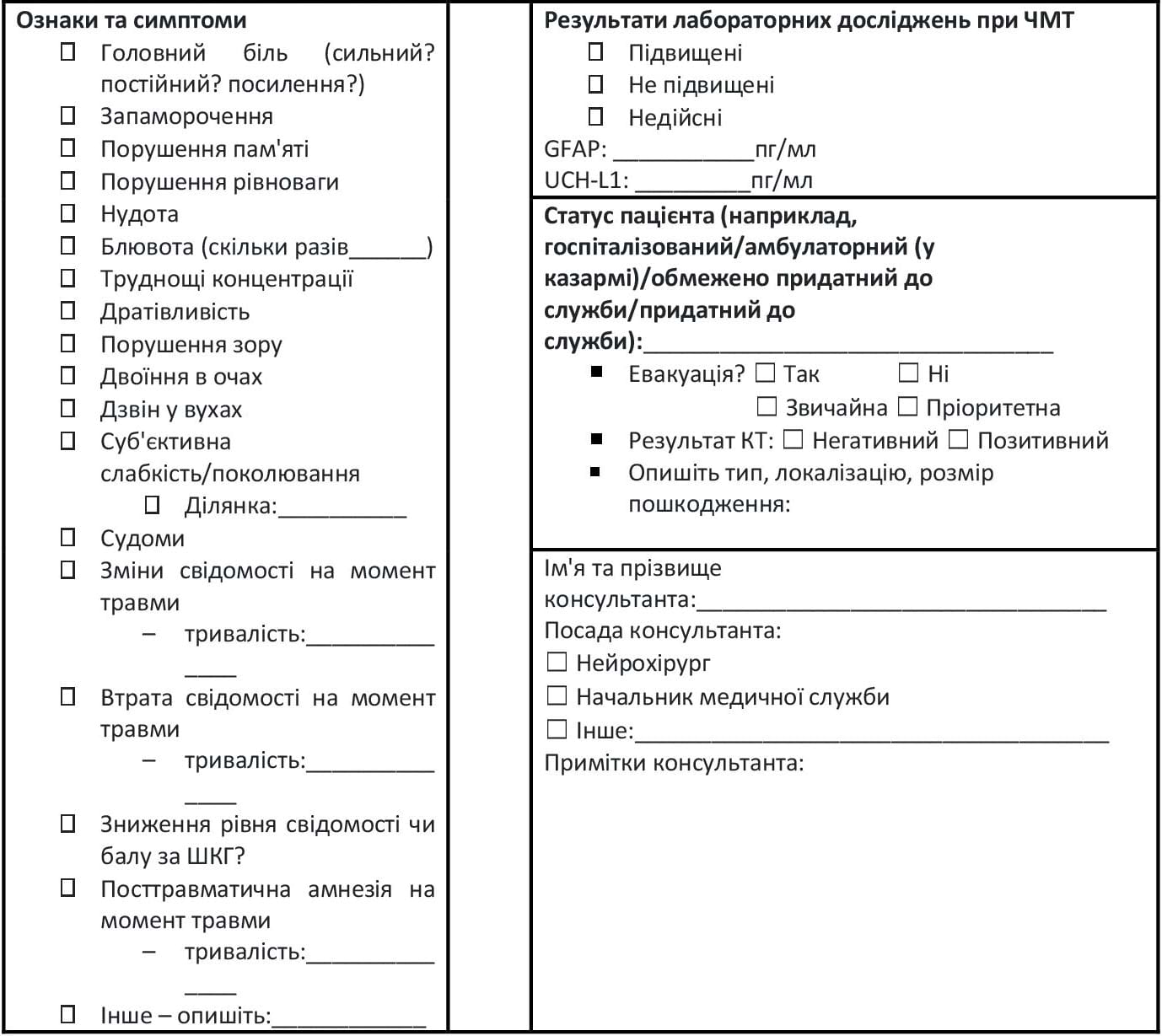
Щоб мінімізувати ризики, пов’язані з використанням цієї нової можливості, ми рекомендуємо висококонтрольоване впровадження у практику біомаркерів ЧМТ. У кожній зоні бойових дій слід призначити консультантів щодо біомаркерів ЧМТ (котрі, як правило, розміщуються на третьому етапі надання допомоги), які будуть мати повноваження інтерпретувати результати та приймати рішення про евакуацію. Ці особи повинні мати досвід у оцінюванні, сортуванні та лікуванні ЧМТ у складних умовах та бути обізнаними щодо клінічного застосування значень біомаркерів ЧМТ. Медичний директор з травми/Начальник медичної служби театру бойових дій має обов’язки керування цими спільними зусиллями, але, як правило, надає можливість прийняття клінічних рішень нейрохірургу або іншому нейроспеціалісту, якщо він доступний. Обов'язковим є одночасне та стандартизоване ведення записів за допомогою Інструменту для збору даних про біомаркери (Додаток D). Цей інструмент стисло передає механізм, ознаки, симптоми, результати обстеження, значення біомаркерів ЧМТ, клінічні рішення, пріоритет евакуації та відповідні результати КТ або наслідки лікування. Обов’язком консультанта є підтримка медичного працівника на передовій під час виконання Алгоритму використання біомаркерів ЧМТ (Додаток А), врахування результатів біомаркерів ЧМТ та прийняття рішення про місце лікування пацієнта. Якщо негативний результат тесту на біомаркери ЧМТ дає змогу прийняти рішення про те, щоб пацієнт залишився на передовій позиції, консультант або начальник медичної служби повинні продовжувати співпрацювати з цим медичним фахівцем, доки це буде необхідно. Ми рекомендуємо консультантам взяти на себе обов’язок контролю заповнення Інструменту для збору даних про біомаркери. Як особа, відповідальна за Програму біомаркерів ЧМТ, начальник медичної служби має проконтролювати, щоб дані Інструменту для збору даних про біомаркери були подані до Об’єднаної системи лікування травм.
Первинна оцінка
Спочатку слід провести оцінку стану та ресусцитацію поранених з гострою травмою, яка може включати події, що потенційно можуть спричинити струс мозку, згідно з Настановами Об’єднаної системи лікування травм, принципами Розширеної підтримки життя при травмах (Advanced Trauma Life Support, ATLS) і протоколами Допомоги пораненим в умовах бойових дій (TCCC). Події, що потенційно можуть спричинити струс мозку (Potentially Concussive Event, PCE), визначені в інструкції 6490.11 Міністерства оборони США та включають:
- ураження внаслідок вибуху, зіткнення або перекидання транспортного засобу;
- перебування в радіусі 50 метрів від вибуху (всередині приміщення чи ззовні);
- прямий удар по голові або втрата свідомості при свідках; та
- вплив більш, ніж однієї вибухової події.
Класифікація Міністерством оборони США травм голови як легких, середнього ступеня або тяжких включає результати візуалізаційних досліджень та звіти про симптоми аж до 7 днів. Таким чином, з метою проведення первинної оцінки в польових умовах найбільш прийнятним є використання Шкали ком Глазго (ШКГ), результати якої мають також і прогностичне значення в умовах бойових дій.
Постраждалі з травмами голови первинно класифікуються відповідно до кількості балів за ШКГ:
- Легкі: ШКГ 13-15
- Середнього ступеня: ШКГ 9-12
- Тяжкі: ШКГ 3-8
ПРИМІТКА: Якщо поранений має 12 або менше балів за ШКГ (ЧМТ середнього або тяжкого ступеня), зверніться до настанов з клінічної практики Об’єднаної системи лікування травм «Нейрохірургія і тяжка травма голови» (Neurosurgery and Severe Head Injury CPG). Дані настанови про біомаркери ЧМТ у таких випадках не застосовуються.
Якщо у пораненого немає інших травм, які вимагають евакуації, він має 13 або більше балів за ШКГ, а тест на плазмові біомаркери ЧМТ недоступний, при проведенні первинної оцінки, на додаток до даних настанов, потрібно керуватися шкалою MACE2 та Додатком 3 інструкції 6490.11 Міністерства оборони США. (Див. Інструкцію 6490.11 Міністерства оборони США у допоміжних ресурсах щодо ЧМТ - DoDI 6490.11)
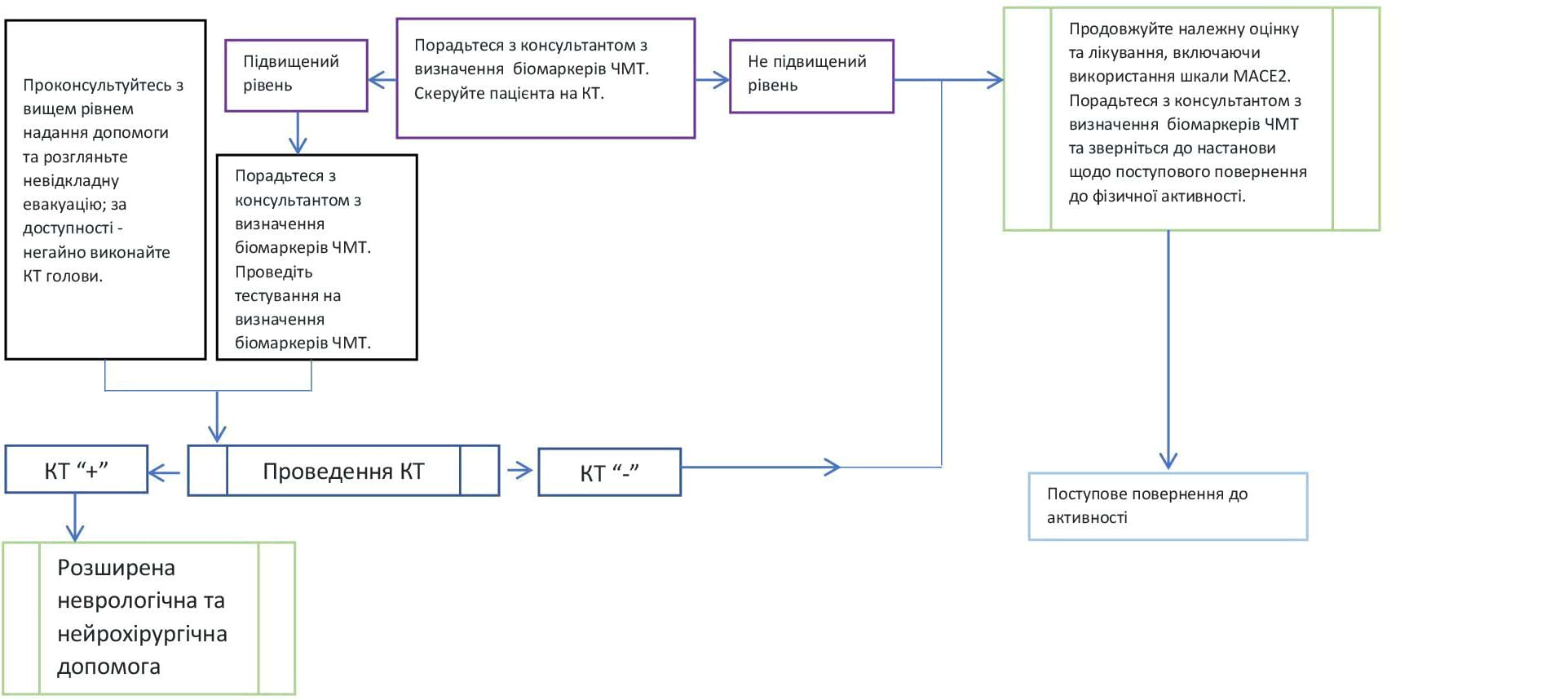
Ці настанови та алгоритм (Додаток A) доповнюють MACE2 і надають первинні вказівки для місць, де є доступ до проведення визначення плазмових біомаркерів ЧМТ. Тест на визначення плазмових біомаркерів ЧМТ слід використовувати замість обстеження за допомогою пристрою для виявлення «структурного ушкодження головного мозку» («structural brain injury» device), що зазначений у MACE 2 під «червоними прапорцями». Однак, важливо зазначити, що даний пристрій (iStat) не дає змоги встановити остаточний діагноз «структурного ушкодження головного мозку», і його слід використовувати та інтерпретувати результати відповідно до визначення у Додатку B. MACE2 не визначає, які особи повинні або не повинні проходити оцінку за допомогою пристрою для виявлення «структурного ушкодження головного мозку». Цей алгоритм має на меті розширити MACE 2, щоб допомогти медичним працівникам відібрати пацієнтів, які мають показання для визначення плазмових біомаркерів ЧМТ для оцінки їхнього стану.
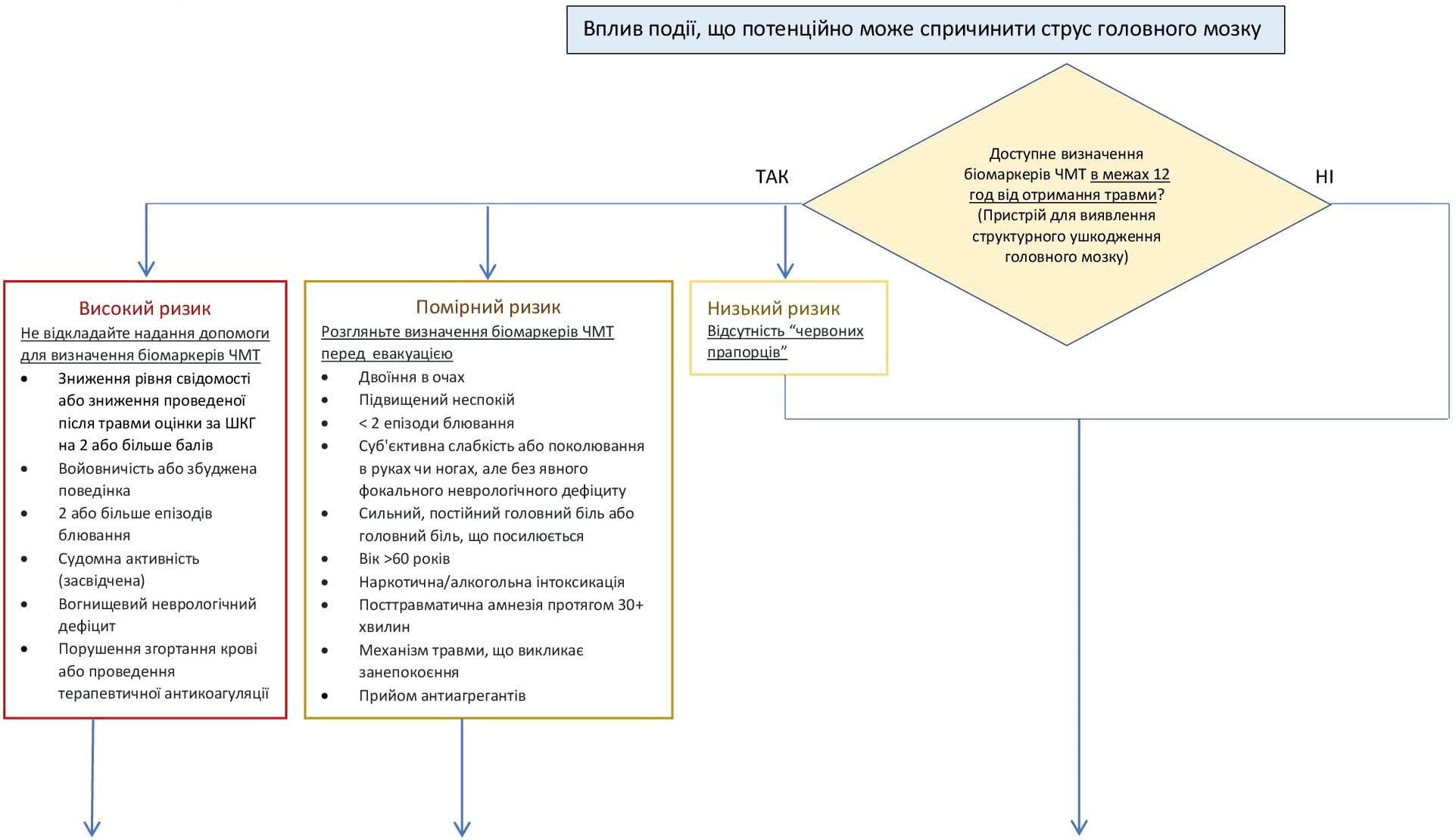
Оцінка високого, помірного або низького ризику ЧМТ та внутрішньочерепного крововиливу
У місцях, де є доступ до проведення тесту на плазмові біомаркери ЧМТ, постраждалого внаслідок події, що потенційно може спричинити струс головного мозку, слід класифікувати відповідно до високого, помірного або низького ризику його розвитку за допомогою алгоритму з Додатка А. Це модифікація шкали MACE2, орієнтована на пацієнтів, які, швидше за все, отримають користь від використання плазмових біомаркерів ЧМТ.
Високий ризик: не відкладайте надання допомоги для визначення плазмових біомаркерів ЧМТ
Підгрупа «червоних прапорців» шкали MACE2 позначає високий ризик ушкодження головного мозку з внутрішньочерепним крововиливом. За присутності будь-якого з наведених нижче симптомів «червоних прапорців», пораненого слід терміново направити на КТ голови. Не відкладайте евакуацію для визначення плазмових біомаркерів ЧМТ.
- Зниження рівня свідомості або зниження проведеної після травми оцінки за ШКГ на 2 або більше балів
- Войовничість або збуджена поведінка
- 2 або більше епізодів блювання
- Судомна активність (засвідчена)
- Вогнищеві неврологічні порушення (дефіцит), такі як асиметрія зіниць, слабкість/асиметрія м’язів обличчя, поява однобічної слабкості або парезів/паралічів кінцівок
- Порушення згортання крові або проведення терапевтичної антикоагуляції з використанням гепарину, низькомолекулярного гепарину, варфарину або нових оральних антикоагулянтів (прямих інгібіторів тромбіну та прямих інгібіторів фактора Ха)
Крім того, поранених із ознаками, що свідчать про проникаючу ЧМТ, втиснений перелом черепа або з ознаками перелому основи черепа (наприклад, «очі єнота» (симптом окулярів), симптом Баттла, отолікворея), слід терміново скерувати на КТ голови.
Помірний ризик: розгляньте визначення плазмових біомаркерів ЧМТ перед поданням запиту на евакуацію
Ця група пацієнтів є цільовою для визначення плазмових біомаркерів ЧМТ. Через значну частоту хибнопозитивних результатів, визначення плазмових біомаркерів ЧМТ рекомендоване у постраждалих із помірним ризиком внутрішньочерепного крововиливу. Мета є в тому, аби дозволити пацієнтам із симптомами захворювання та нормальним результатом тестування утриматись від проведення КТ і залишитися на місці з обмеженням фізичної активності (наприклад, ліжковий режим у місці базування/казармі) та симптоматичним лікуванням. Є два важливі застереження щодо цієї групи:
- Струс мозку стався не раніше 12 годин до проведення тестування.
- У пацієнта не повинно бути інших ушкоджень, що потребують термінової евакуації (переломи, підозра на внутрішні пошкодження тощо). У цьому випадку тестування не повинно затримувати транспортування для вирішення більш термінових питань, але все одно може бути виконане.
Поранені без «червоних прапорців» високого ризику або симптомів, описаних вище, але у яких спостерігається одна або декілька з наведених нижче ознак, є кандидатами на визначення плазмових біомаркерів ЧМТ.
- Двоїння в очах
- Підвищений неспокій
- < 2 епізоди блювання
- Суб'єктивна слабкість або поколювання в руках чи ногах, але без явного фокального неврологічного дефіциту
- Сильний, постійний головний біль або головний біль, що посилюється
- Вік >60 років
- Прийом антиагрегантів (таких як аспірин або ібупрофен)
- Наркотична/алкогольна інтоксикація
- Посттравматична амнезія (неможливість пригадати події, що відбулись протягом 30 або більше хвилин до травми)
- Механізм травми, який викликає занепокоєння: зіткнення або перекидання дорожньо-транспортного засобу на великій швидкості; падіння з висоти понад 1 метр; або перебування у радіусі 50 м від центра вибуху (всередині приміщення чи ззовні).
У постраждалих із будь-якою з цих ознак слід визначити плазмові біомаркери ЧМТ, якщо дослідження виконується в межах 12 годин після первинної травми голови. Далі, використовуючи всі клінічні деталі, окреслені в Інструменті для збору даних про біомаркери (Додаток D), медичний працівник на передовій зв’язується з консультантом із визначення біомаркерів ЧМТ, після чого вони приймають рішення щодо необхідності проведення КТ голови та пріоритетності евакуації. Якщо вирішується, що пацієнт може залишатися на місці з обмеженням фізичної активності та отримувати лікування, описане в розділі нижче, медик та консультант повинні скласти план комунікації для інформування про зміни стану постраждалого.
Низький ризик ЧМТ: відсутність факторів ризику
Якщо поранений не має жодного з факторів ризику з описаних вище, медичний працівник повинен надати йому допомогу, як описано в MACE2. Якщо погіршення стану розвивається пізніше, ніж через 12 годин після первинної травми, медик повинен зв’язатися з призначеним консультантом із визначення біомаркерів ЧМТ.
Дослідження показують, що деякі поранені без наявних “червоних прапорців” за шкалою MACE2 підлягають евакуації для проведення КТ голови, незважаючи на рекомендації шкали. Якщо медик призначає КТ голови пораненому без ознак або симптомів високого чи помірного ризику, описаних вище, перед скеруванням на дане дослідження слід провести тест на плазмові біомаркери ЧМТ (якщо поранений оглядається в межах 12 годин після отримання травми).
Настійно рекомендується порадитися з призначеним консультантом із визначення біомаркерів ЧМТ, щоб допомогти визначити терміновість скерування та евакуації.
Місця з можливістю проведення КТ голови
Визначення плазмових біомаркерів ЧМТ є новою можливістю як для військового, так і для цивільного сектора. Таким чином, настанови з клінічної практики щодо використання плазмових біомаркерів ЧМТ ще не розроблені цивільними професійними товариствами. Коли існують можливості проведення КТ голови на місці або ж евакуація несе мінімальний ризик, медики можуть розглянути можливість визначення як плазмових біомаркерів ЧМТ, так і проведення КТ голови для отримання додаткового досвіду роботи з біомаркерами у клінічних та бойових умовах. Під час цього вкрай важливо заповнити Інструмент для збору даних про біомаркери та надіслати його консультанту або медичному директору з травми/начальнику медичної служби з метою збору даних щодо цієї новітньої технології.
Первинний струс мозку внаслідок дії вибухової хвилі
Плазмові біомаркери ЧМТ був перевірено на цивільних пацієнтах із тупою травмою, і наразі невідомо, як тест працюватиме на постраждалих, що отримали легку ЧМТ внаслідок первинного впливу вибухової хвилі. Це підкреслює важливість збору даних за допомогою процесів, викладених у даних настановах з клінічної практики, та подання їх до Об’єднаної системи лікування травм.
Симптоматичне лікування ЧМТ легкого ступеня
Основою лікування військовослужбовців з ЧМТ легкого ступеня є відносний спокій і первинне лікування симптомів. Військовослужбовці з легкою ЧМТ повинні проходити лікування відповідно до Інструкції 6490.11 Міністерства оборони США, опублікованого Центром передового досвіду лікування ЧМТ алгоритму MACE2 і Клінічних рекомендацій щодо поступового повернення до фізичної активності. Багато постраждалих із «позитивними» (підвищеними) показниками плазмових біомаркерів ЧМТ не матимуть ознак травми головного мозку чи внутрішньочерепного крововиливу на КТ-сканах голови, але матимуть ознаки пошкодження головного мозку, видимі на МРТ-знімках.11 При цьому, підвищені рівні плазмових біомаркерів ЧМТ не схвалені FDA для діагностики легкої ЧМТ і не повинні використовуватися як єдиний показник діагностики даного стану; для встановлення цього діагнозу необхідне проведення клінічної оцінки пораненого. На даний момент невідомо, чи слід проводити лікування поранених із «позитивними» (підвищеними) рівнями плазмових біомаркерів ЧМТ без ознак травми на КТ голови в інший спосіб, ніж пацієнтів із «негативними» (непідвищеними) показниками біомаркерів. Тому осіб із підвищеними рівнями біомаркерів та негативним результатом КТ голови слід вести як постраждалих із легкою ЧМТ відповідно до настанов Міністерства оборони США, наведених у попередньому параграфі.
Моніторинг покращення ефективності (ПЕ)
Досліджувана група
Постраждалі, які потенційно зазнали струсу мозку.
Мета (Очікувані результати)
- Задокументовані бали за ШКГ, неврологічне обстеження, оцінка за шкалою MACE2 та симптоми кожного військовослужбовця, який постраждав внаслідок події, що потенційно може спричинити струс головного мозку.
- Виконано визначення плазмових біомаркерів ЧМТ у пацієнтів із помірним ризиком в межах 12 годин після отримання травми.
- Проінформовано консультанта із визначення біомаркерів ЧМТ щодо всіх позитивних та негативних результатів тестів з метою заповнення Інструменту для збору даних про біомаркери (Додаток D).
- Дані про біомаркери подаються/надсилаються електронною поштою до Об’єднаної системи лікування травм: dha.jbsa.healthcare-ops.list.tbi-biomarker@health.mil
Показники результативності/дотримання рекомендацій
- Обстеження за шкалою MACE2 задокументоване для всіх військовослужбовців з діагнозом легкої ЧМТ
- У медичній картці пацієнта задокументовані результати визначення плазмових біомаркерів ЧМТ
Джерела даних
- Медична картка пацієнта
- Реєстр травм Міністерства оборони США (DoDTR)
Системна звітність та її частота
- Вищезазначене визначає мінімальні критерії для моніторингу покращення ефективності даних Настанов з клінічної практики. Системна звітність має здійснюватися щорічно; за потреби може виконуватися додатковий моніторинг покращення ефективності та системне звітування.
- Системний огляд та аналіз даних виконуються керівником Об'єднаної системи лікування травм та відділом покращення ефективності.
Обов'язки
Керівник команди з надання допомоги при травмах відповідає за ознайомлення з даними Настановами з клінічної практики, належне дотримання вказаних у ній вимог та моніторинг ПЕ на місцевому рівні.
-
- Excellence TBICo. Department of Defense Numbers for Traumatic Brain Injury Worldwide — Totals 2020; https://health.mil/About-MHS/OASDHA/Defense-Health-Agency/Research-and-Development/Traumatic-Brain-Injury-Center-of-Excellence/DoD-TBI-Worldwide-Numbers. Accessed 11 Feb 2021.
- Lange RT, Lippa SM, French LM, et al. Long-term neurobehavioural symptom reporting following mild, moderate, severe, and penetrating traumatic brain injury in U.S. military service members. Neuropsychol Rehabil. 2020;30(9): 1762-1785. https://doi.org/10.1080/09602011.2019.1604385 Accessed Aug 2021.
- Phipps H, Mondello S, Wilson A, et al. Characteristics and impact of U.S. military blast-related mild traumatic brain injury: a systematic review. Front Neurol. 2020;11: 559318. https://doi.org/10.3389/fneur.2020.559318. Accessed Aug 2021.
- Schwab K, Terrio HP, Brenner LA, et al. Epidemiology and prognosis of mild traumatic brain injury in returning soldiers: A cohort study. Neurology. 2017;88(16): 1571-1579. https://doi.org/10.1212/wnl.0000000000003839.
- Stahlman S, Taubman SB. Incidence of acute injuries, active component, U.S. Armed Forces, 2008-2017. Msmr. 2018;25(7): 2-9.
- Foks KA, van den Brand CL, Lingsma HF, et al. External validation of computed tomography decision rules for minor head injury: prospective, multicentre cohort study in the Netherlands. BMJ. 2018;362: k3527. https://doi.org/10.1136/bmj.k3527.
- Bazarian JJ, Biberthaler P, Welch RD, et al. Serum GFAP and UCH-L1 for prediction of absence of intracranial injuries on head CT (ALERT-TBI): a multicentre observational study. Lancet Neurol. 2018;17(9): 782-789. https://doi.org/10.1016/s1474-4422(18)30231-x. Accessed Aug 2021.
- Dengler BA, Agimi Y, Stout K, Caudle KL, Curley KC, Sanjakdar S, Rone M, Dacanay B, Fruendt JC, Phillips JB, Meyer AL. Epidemiology, patterns of care and outcomes of traumatic brain injury in deployed military settings: implications for future military operations.
- Haydel MJ, Preston CA, Mills TJ, Luber S, Blaudeau E, DeBlieux PM. Indications for computed tomography in patients with minor head injury. N Engl J Med. 2000;343(2): 100-105. https://doi.org/10.1056/nejm200007133430204. Accessed Aug 2021.
- Stiell IG, Wells GA, Vandemheen K, et al. The Canadian CT Head Rule for patients with minor head injury. Lancet. 2001;357(9266): 1391-1396.
- Yue JK, Yuh EL, Korley FK, et al. Association between plasma GFAP concentrations and MRI abnormalities in patients with CT-negative traumatic brain injury in the TRACK-TBI cohort: a prospective multicentre study. Lancet Neurol. 2019;18(10): 953-961. https://doi.org/10.1016/s1474-4422(19)30282-0. Accessed Aug 2021.
Додаток A: Клінічний алгоритм використання біомаркерів ЧМТ крові
Клінічний алгоритм первинного лікування пацієнта після події, що потенційно може спричинити струс головного мозку, із використанням плазмових біомаркерів ЧМТ
Додаток В: Детальна інформація про плазмові біомаркери ЧМТ
ПРИМІТКА. Узагальнена інформація з Abbott Point of Care Inc., 2021, 510(k) Summary: i-STAT TBI Plasma Cartridge with the i-STAT Alinity System (K201778; Approved 8JAN2021).(Картридж i-STAT для визначення плазмових маркерів ЧМТ із системою Alinity (K201778; затверджено 8 січня 2021 року)). https://www.accessdata.fda.gov/cdrh_docs/pdf20/K201778.pdf
Тип пристрою: Аналізатор, система для обстеження при черепно-мозкових травмах
Назва пристрою: Картридж i-STAT для визначення плазмових маркерів ЧМТ із системою i-STAT Alinity
Опис пристрою та процесу аналізу:
- Напівкількісний мультиплексний імуноаналіз плазми з антикоагулянтом - етилендіамінтетраоцтовою кислотою (ЕДТА) - для визначення:
- Гліального фібрилярного кислого протеїну (GFAP)
- Убіквітинової карбокситермінальної гідролази L1 (UCH-L1)
- Картридж можна використовувати лише з системою i-STAT Alinity.
- Картридж надасть повідомлення про помилку зчитування, якщо використовується з аналізатором i-STAT 1.
- Щоб відокремити плазму, кров потребує обробки в умовах клінічної лабораторії з наявністю центрифуги.
- Картриджі вимагають зберігання в холодильнику; рідини для калібрування/перевірки та контролю потребують морозильної камери для зберігання.
- Не є швидким портативним тестом, який можна виконати “біля ліжка хворого”; ця можливість може з’явитись у майбутніх продуктах.
Діапазон референтних значень аналізу: Діапазон, отриманий від обстеження 225 здорових осіб без неврологічних захворювань в анамнезі:
- GFAP: Середнє значення - 19 пг/мл; Медіана - 15 пг/мл; Референтний інтервал - 2-51 пг/мл (2,5-97,5-й перцентиль)
- UCH-L1: Середнє значення - 81 пг/мл; Медіана - 71 пг/мл; Референтний інтервал - 21-204 пг/мл (2,5-97,5-й перцентиль)
Граничні значення та результати аналізу:
- Підвищений: Такий результат вказується тоді, коли рівень GFAP АБО UCH-L1 є вищим за норму
- Пороговий рівень GFAP: 30 пг/мл
- Пороговий рівень UCH-L1: 360 пг/мл
- Не підвищений: Результат вважається нормальним, якщо рівні GFAP ТА UCH-L1 нижчі від порогових значень.
- Не реєструється: Результат не надається, якщо дійсні показники є нижчими від порогового значення ТА один або більше результатів не реєструються
Ефективність аналізу
У рамках процесу ліцензування Управлінням по контролю якості харчових продуктів та лікарських засобів (FDA) США було проведено два дослідження.
Дослідження №1: Це дослідження проводилося на попередньо збережених зразках плазми і продемонструвало ефективність, порівнювану з аналізом біомаркерів Banyan з :
Дослідження №2: Це дослідження було проведено на свіжих зразках плазми та продемонструвало порівняно вищу чутливість, але нижчу специфічність.
Повідомлення про використання за призначенням
Визначення плазмових маркерів ЧМТ на аналізаторі i-STAT — це панель діагностичних імуноаналізів для кількісних вимірювань GFAP і UCH-L1 у плазмі in vitro та напівкількісної інтерпретації результатів тесту, отриманих на основі цих вимірювань, за допомогою аналізатора i-STAT Alinity. Інтерпретовані результати тесту у поєднанні з іншою клінічною інформацією використовуються для допомоги під час оцінки пацієнтів віком 18 років і старше, які мають підозру на легку ЧМТ (13-15 балів за ШКГ) в межах 12 годин після травми, для визначення необхідності проведення КТ голови. Результат “Не підвищений” пов’язаний з відсутністю гострих травматичних внутрішньочерепних уражень на КТ-знімках голови. Тест повинен виконуватися медичним працівником. Слід використовувати плазму, приготовлену зі зразків крові з доданим антикоагулянтом (ЕДТА) в умовах клінічної лабораторії. Визначення плазмових маркерів ЧМТ за допомогою пристрою i-STAT не є швидким портативним тестом, який проводиться “біля ліжка хворого”.
Додаток С: Результати дослідження
Загальний огляд доказових даних
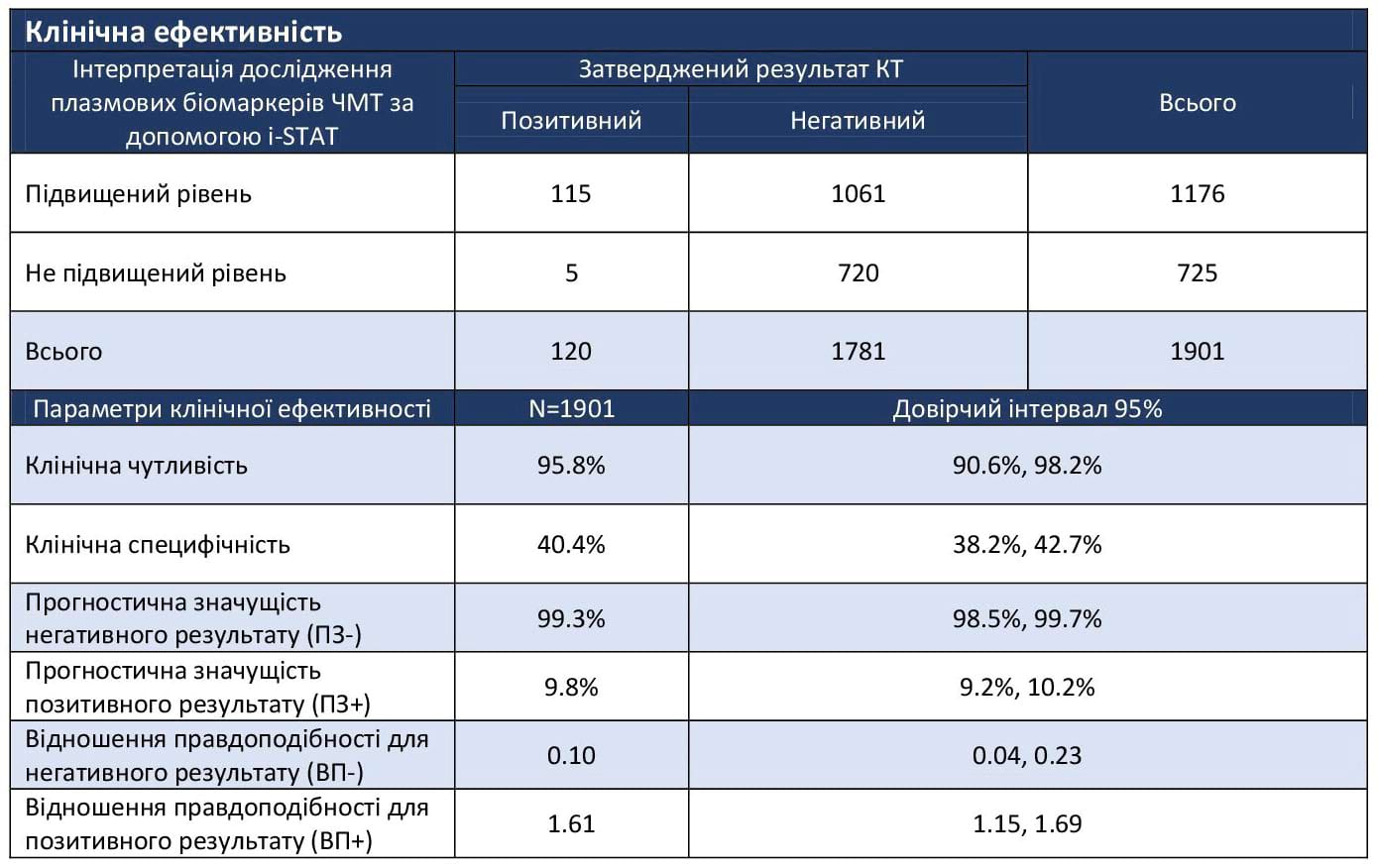
Було проведено два дослідження для підтримки запиту на отримання ліцензії від FDA.1 У першому дослідженні використовувалися заморожені зразки плазми, отримані під час дослідження, проведеного на підтримку системи аналізу біомаркерів ЧМТ Banyan.2 Це дослідження (n=1901) продемонструвало подібну до аналізу біомаркерів Banyan ефективність з чутливістю 95,8%, прогностичною значущістю негативного результату 99,3% і специфічністю 40,4% [95% ДІ 38,2%, 42,7%]. Отримано 5 хибнонегативних результатів тесту; жоден з цих випадків не потребував хірургічного втручання.2
У другому дослідженні використовували невеликі об’єми свіжих зразків плазми (n=88), отриманих від невеликої підгрупи пацієнтів, яким проводилося КТ голови при оцінці ЧМТ у травма-центрах першого рівня. У цій вибірці чутливість і прогностична значущість негативного результату склали 100%, але специфічність була нижчою - 23,7%. Причина появи нижчого показника у цій групі невідома, але така зміна могла бути пов’язана з малим об’ємом зразків або відмінностями в досліджуваній групі. Наприклад, у першому дослідженні лише в 6% пацієнтів зафіксовано зміни на КТ голови, в той час як у другому досліджені їх мали 33% осіб. Показники прогностичної значущості позитивного результату для кожного з досліджень були подібними після врахування поправки на переважання позитивних знахідок на КТ голови.
Незважаючи на те, що специфічність аналізу щодо травми головного мозку та крововиливу, видимих на КТ, коливається від низької до помірної, додаткові дослідження показують, що багато пацієнтів із підвищеним вмістом гліального фібрилярного кислого протеїну, визначеного за допомогою прототипу аналізу, мають докази травми мозку на МРТ.3 Важливо зауважити, що аналіз не схвалений FDA для цієї мети.1
Підсумок дослідження №1
Заморожені зразки плазми були отримані в дослідженні Bazarian та ін., яке використовувалося для схвалення попередньої версії аналізу біомаркерів ЧМТ Banyan. 1,2
- Критерії включення/виключення: Дорослі віком ≥18 років, які були скеровані до відділення екстреної медичної допомоги з непроникаючою ЧМТ і 13-15 балами за ШКГ, та яким було рекомендовано проведення КТ голови (медичним працівником, що їх скерував), з виконаним в межах 12 годин від отримання травми аналізом крові (можливе виконання у 22 закладах на території США та Європи).
- Середній вік вибірки (n=1901) складав 49,0 років з діапазоном від 18 до 98 років. Більше половини досліджуваних (56,6%) були чоловіками, 70,6% були білими і 26,2% були афроамериканцями.
- Майже всі мали 15 балів за ШКГ (94,1%) і близько половини мали втрату свідомості (42,2%), зміну свідомості (56,3%) або видиму травму вище ключиць (63,3%). Близько третини повідомили про посттравматичну амнезію (33,0%).
- Середній час між травмою та взяттям крові становив 3,2 години з діапазоном від 0,3 до 11,9 годин.
Таблиця 1. Клінічна ефективність
П’ять осіб мали хибнонегативні результати (тобто не підвищені показники біомаркерів та знахідки на КТ голови). Жодна з цих осіб не потребувала хірургічного втручання. КТ-знахідки включали в себе невеликий субарахноїдальний та субдуральний крововиливи, а також венозну ангіому, яка, скоріш за все, була вродженою аномалією. Див. Мал. 1, де зображені 3 з 5-ти КТ-знімків голови пацієнтів з хибнонегативними результатами.
Малюнок 1. КТ-знімки голови пацієнтів із хибнонегативними результатами.
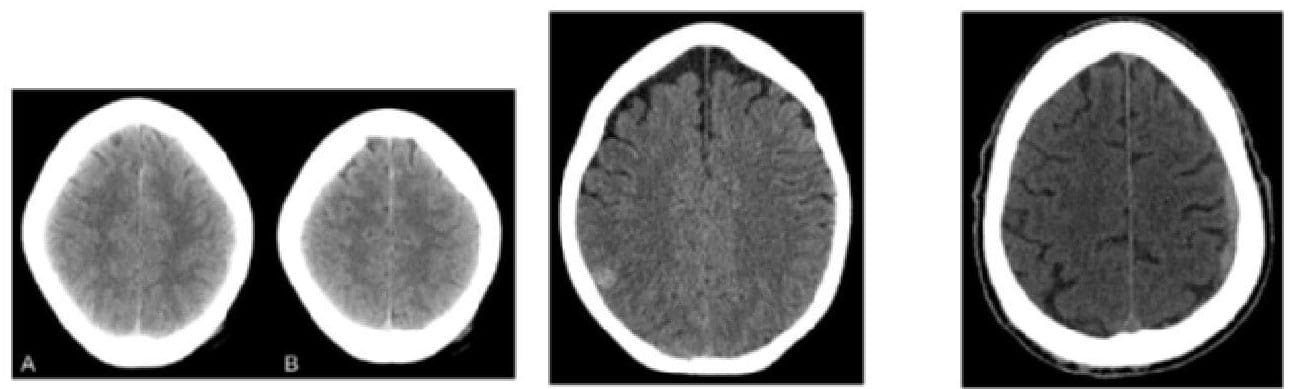
Опис: Ліворуч (пацієнт №1) – на двох нативних КТ-зображеннях (A + B) візуалізується вогнищевий субарахноїдальний крововилив у передній і присередній лобовій борознах. Посередині (пацієнт №2) – на нативному КТ-зображенні видно фокальну зону підвищеної щільності в задній правій тім’яній частці. На основі зрізів нижчих відділів (не показані) висунуто припущення про набряк (зону низького поглинання), який обмежує ділянку контузії. Справа (пацієнт №3) – на нативному КТ-зображенні вздовж бічної поверхні лівої півкулі візуалізується субдуральний крововилив, що знаходиться над лобовою та тім’яною частками, і створює мінімальний локальний мас-ефект на паренхіму головного мозку.
Підсумок дослідження №2
Свіжі зразки плазми були отримані з чотирьох клінічних центрів США, що брали участь у дослідженні “Transforming Research and Clinical Knowledge in Traumatic Brain Injury” (TRACK-TBI).1,3
- Критерії включення/виключення: Дорослі віком ≥18 років, які були скеровані до відділення екстреної медичної допомоги, з 13-15 балами за ШКГ та виконаним КТ голови (в одному з чотирьох медичних центрів даного дослідження).
- Середній вік вибірки (n=88) складав 42,5 років з діапазоном від 18 до 85 років. Майже 3/4 досліджуваних (71,2%) були чоловіками.
- Більшість з них мали 15 балів за ШКГ (81,8%), а також більше половини мали втрату свідомості (68,2%), сплутаність свідомості (67,0%) або посттравматичну амнезію (68,2%).
- Середній час між травмою та взяттям крові становив 4,3 години з діапазоном від 2,0 до 11,8 годин.
Таблиця 2. Клінічна ефективність – Додаткове дослідження зразків свіжої плазми
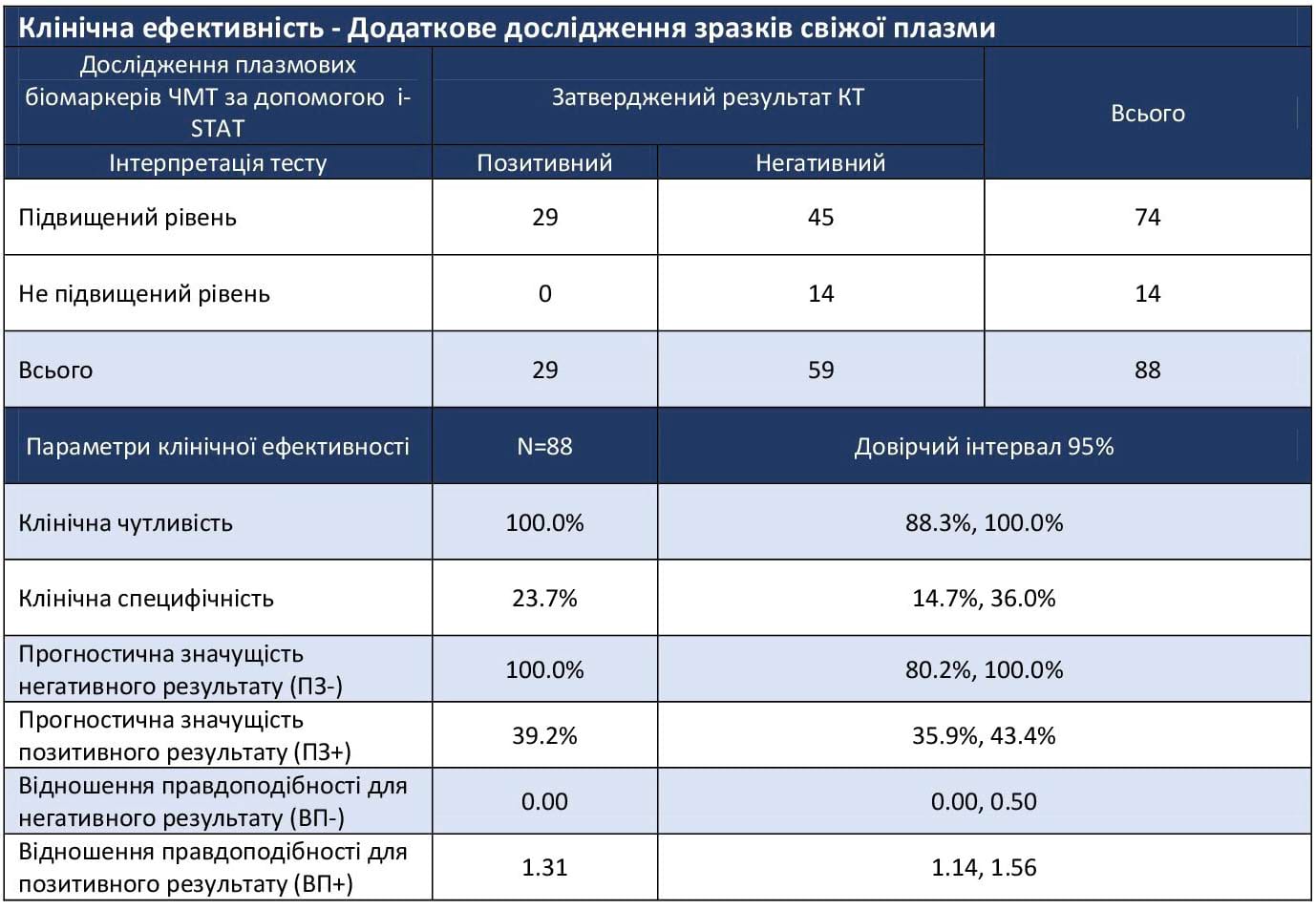
Примітка: *Рівні поширеності ПЗ- та ПЗ+ серед позитивних результатів КТ для пацієнтів із підозрою на легку ЧМТ були оцінені у 33,0%. Скориговані на 6% ПЗ- і ПЗ+ (для порівняння з основним дослідженням) становлять 100,0% (95% ДІ: 96,9%, 100,0%) і 7,7% (95% ДІ: 6,8%, 9,1), відповідно.
Підсумок дослідження GFAP/МРТ
У дослідженні, проведеному у 18 травма-центрах США першого рівня впродовж 2014-2018 років, брали участь дорослі з балом за ШКГ 13-15, які були скеровані до лікувального закладу в межах 24 годин після ушкодження голови та яким було проведено КТ, а також МРТ голови протягом 7-18 днів після отримання травми. 1,3
- З 1375 осіб, залучених до дослідження TRACK-TBI, негативний результат КТ голови (з 13-15 балів за ШКГ) мали 794 осіб, з них 450-м було виконано МРТ-сканування протягом 7-18 днів. 27% осіб з останньої вибірки мали позитивний результат МРТ.
- Особи з позитивним результатом КТ голови мали найвищі рівні GFAP (медіана - 786,0 пг/мл); далі були ті, хто мав негативний результат КТ та позитивний результат МРТ (медіана GFAP - 414,4 пг/мл); найнижчим рівень GFAP був в осіб з негативними результатами КТ та МРТ голови (медіана GFAP - 74,0 пг/мл). Слід зазначити, що здорові особи (медіана GFAP - 8,0 пг/мл) і люди з ортопедичними травмами (медіана GFAP - 13,1 пг/мл), що відносились до контрольної групи, мали значно нижчі рівні GFAP (Таб. 3/Мал. 2).
- З патофізіологічної точки зору підвищені рівні GFAP спостерігалися при травматичному аксональному пошкодженні, дифузному аксональному пошкодженні, екстрааксіальних та змішаних ураженнях (див. Мал.2).
- Чутливість і специфічність рівнів GFAP у випадку позитивного результату МРТ наведені в таблиці 4. Слід зазначити, що рівні GFAP вище 282,70 пг/мл мають специфічність 80,3% для позитивного результату МРТ.
Таблиця 3. Концентрації GFAP у плазмі в залежності від модальності та знахідок на КТ/МРТ
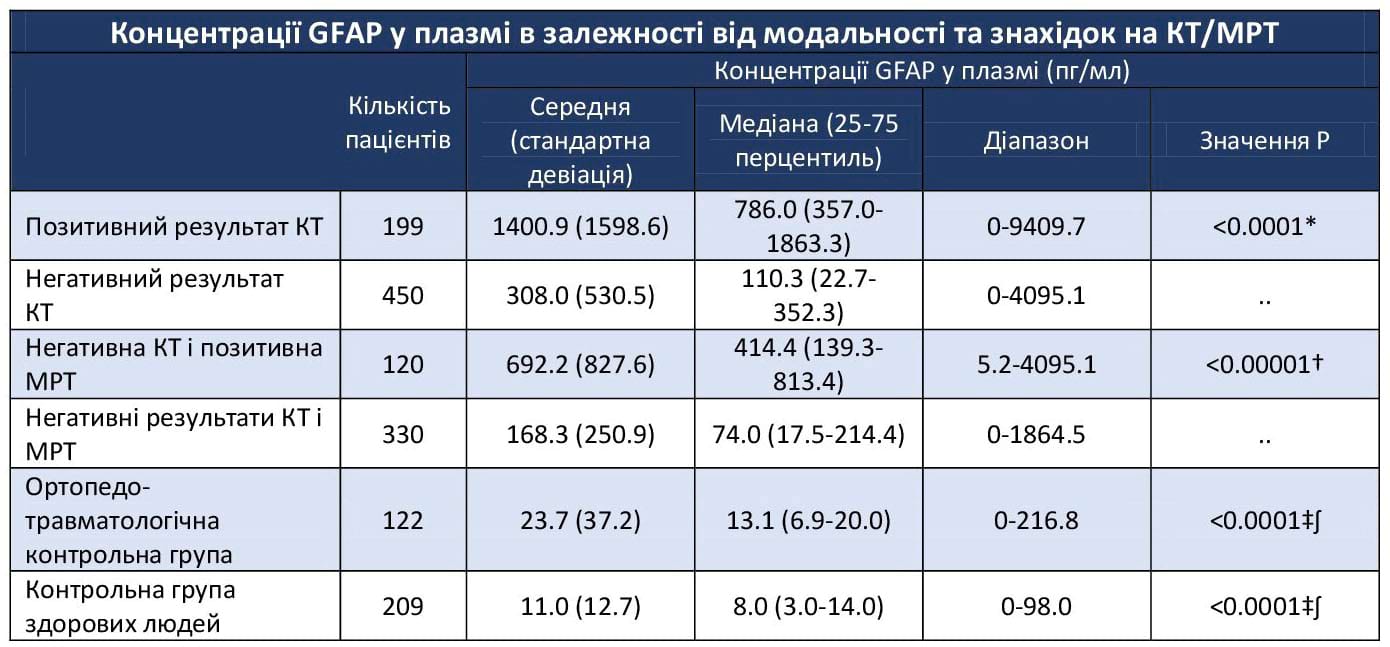
GFAP = гліальний фібрилярний кислий протеїн. Значення P розраховувалися за критерієм суми рангів Вілкоксона для вибірок, що порівнює розподіли двох груп. *Порівняно з пацієнтами із негативним результатом КТ. †Порівняно з пацієнтами із негативними результатами КТ і МРТ. ‡Порівняно з пацієнтами із негативними результатами КТ і позитивними результатами МРТ. ꭍ Порівняно з пацієнтами із негативними результатами КТ і МРТ.
Література, наведена у цьому додатку:
- Vos PE Jacobs B Andriessen TMJC et al. GFAP and S100B are biomarkers of traumatic brain injury: an observational cohort study. Neurology. 2010; 75: 1786-1793
- Metting Z Wilczak N Rodiger LA Schaaf JM van der Naalt J. GFAP and S100B in the acute phase of mild traumatic brain injury. Neurology. 2012; 78: 1428-1433
- Okonkwo DO Yue JK Puccio AM et al. GFAP-BDP as an acute diagnostic marker in traumatic brain injury: results from the prospective Transforming Research and Clinical Knowledge in Traumatic Brain Injury study. J Neurotrauma. 2013; 30: 1490-1497
Малюнок 2. Концентрація GFAP при патології, виявленій на МРТ
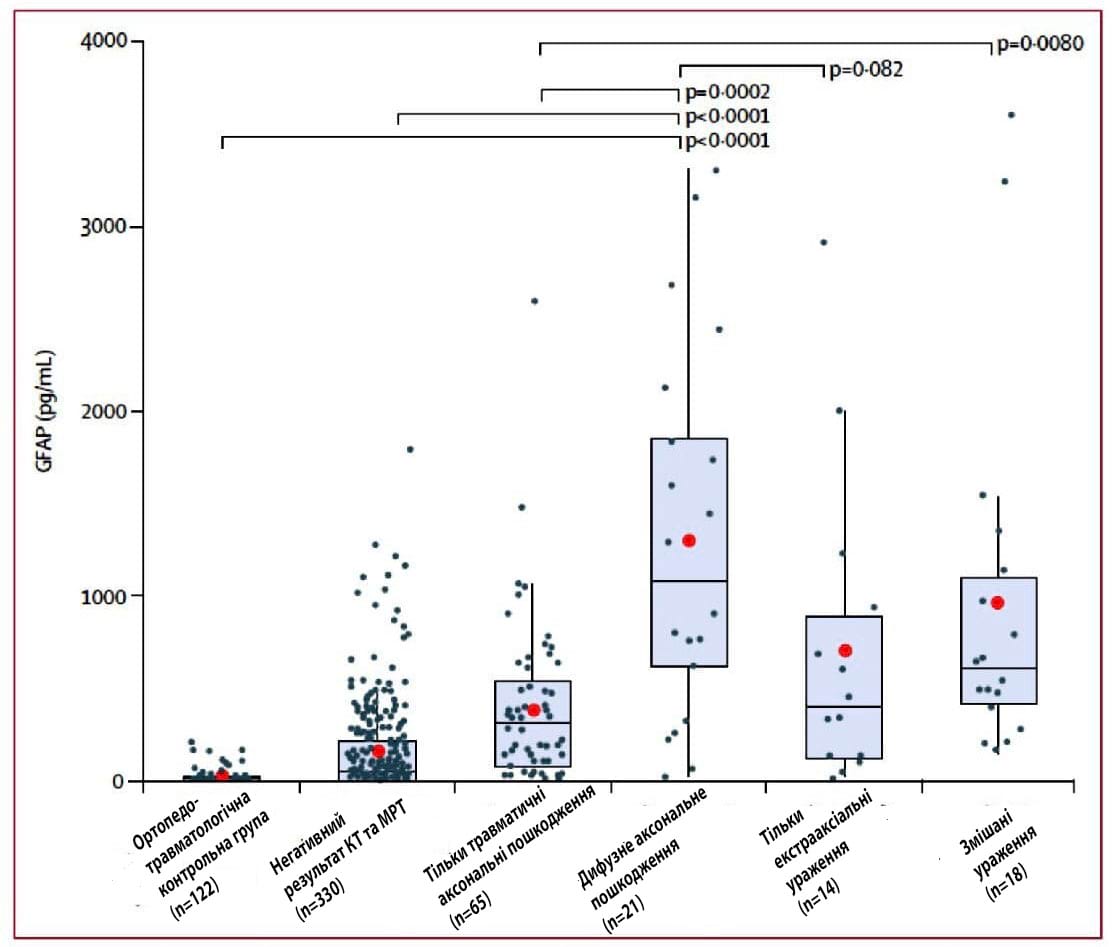
Червона крапка означає середню концентрацію GFAP у плазмі; діаграми-розмаху (прямокутники) показують діапазон, медіану та 25-75-й перцентилі. Індивідуальні значення точок наносяться на графік для довідки. Тест Dunn Kruskal-Wallis для порівняння різних типів уражень на МРТ з корекцією Бенджаміна-Хохберга для численних порівнянь23 показав, що концентрації GFAP є значно вищими у пацієнтів з ізольованим дифузним аксональним пошкодженням, ніж у осіб з ізольованим травматичним аксональним пошкодженням. Окремі тести сум рангів Вілкоксона також показали значно вищі концентрації GFAP у пацієнтів з ізольованим дифузним аксональним пошкодженням, ніж у пацієнтів з негативними результатами КТ і МРТ, а також у ортопедичних пацієнтів з групи контролю. Значення P відображаються для відповідних порівнянь. Два пацієнти з ізольованими внутрішньомозковими контузіями (GFAP 14,9 пг/мл, 285±4 пг/мл) не були включені до діаграми-розмаху. GFAP = гліальний фібрилярний кислий протеїн.
Таблиця 4. Порогові концентрації GFAP у плазмі для прогнозування МРТ-позитивних та МРТ-негативних знахідок у пацієнтів із негативним результатом КТ
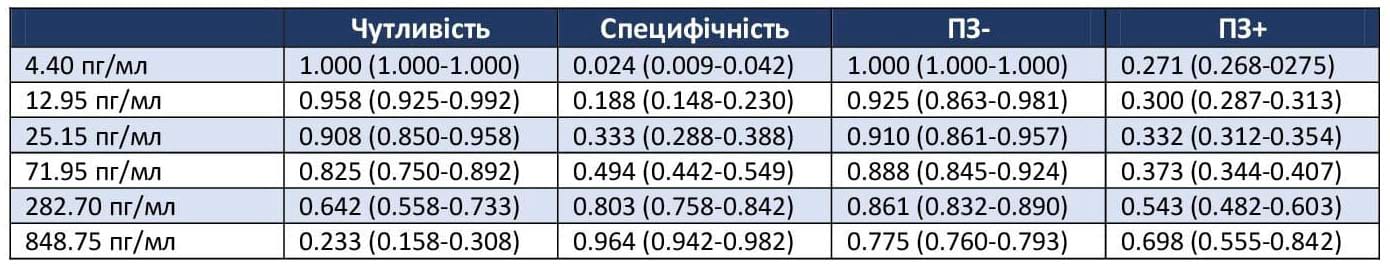
Метод k-кратної перехресної перевірки використовувався для вибору оптимальних порогових значень з метою прогнозування позитивних результатів МРТ на противагу до негативних знахідок у пацієнтів з негативним результатом КТ. За основу були взяті критерії скоригованого ПЗ- вище рівня 0,96; 0,94; 0,92 та 0,90; 0,85 та 0,80 відповідно до стандартів даних для клінічних лабораторних досліджень, встановлених виробником. На основі частоти вибірки для розрахунку скоригованого ПЗ-, поширеність позитивних МРТ-сканів серед пацієнтів з негативними результатами КТ була оцінена як 0,27. Було проведено 1000 генерувань вибірки бутстреп-методом (bootstrap) із використанням медіани кожного циклу для визначення оптимальних порогових значень. Оптимальні порогові значення були застосовані до всіх даних для розрахунку відповідної чутливості, специфічності, ПЗ- та ПЗ+. GFAP = гліальний фібрилярний кислий протеїн. ПЗ- = негативне прогностичне значення. ПЗ+ = позитивне прогностичне значення.
Додаток D: Інструмент збору даних про біомаркери
Надіслати на адресу: dha.jbsa.healthcare-ops.list.tbi-biomarker@health.mil
Додаток Е: Інформація щодо не передбаченого інструкцією застосування лікарських засобів у настановах з клінічної практики
Мета
Мета цього Додатка — надати роз’яснення політики та практики Міністерства оборони США щодо включення в Настанови з клінічної практики «незатвердженого» застосування продуктів, які були схвалені Управлінням з контролю якості продуктів харчування і лікарських засобів США (FDA). Це стосується використання препаратів не за призначенням для пацієнтів, які належать до Збройних сил США.
Вихідна інформація
Незатверджене (тобто «не за призначенням» - “off-label”) використання продуктів, схвалених FDA, надзвичайно поширене в медицині США і зазвичай не регулюється окремими нормативними актами. Проте, згідно з Федеральним законодавством, за деяких обставин застосування схвалених лікарських засобів за незатвердженими показаннями регулюється положеннями FDA про «досліджувані нові ліки». До цих обставин належить використання в рамках клінічних досліджень, а також, у військовому контексті, використання за незатвердженими показаннями згідно з вимогами командування. Деякі види використання за незатвердженими показаннями також можуть підлягати окремим нормативним актам.
Додаткова інформація щодо застосування за незатвердженими показами у настановах з клінічної практики
Включення до Настанов з клінічної практики використання медикаментів за незатвердженими показаннями не належить до клінічних випробувань і не є вимогою командування. Більше того, таке включення не передбачає, що Військова система охорони здоров’я вимагає від медичних працівників, які працюють в структурах Міноборони США, застосовувати відповідні продукти за незатвердженими показаннями або вважає це «стандартом медичної допомоги». Швидше, включення до CPGs використання засобів «не за призначенням» має поглиблювати клінічне судження відповідального медичного працівника шляхом надання інформації щодо потенційних ризиків та переваг альтернативного лікування. Рішення приймається на основі клінічного судження відповідальним медичним працівником у контексті відносин між лікарем і пацієнтом.
Додаткові процедури
Виважений розгляд
Відповідно до цієї мети, в обговореннях використання медикаментів «не за призначенням» в CPG конкретно зазначено, що це використання, яке не схвалено FDA. Крім того, такі обговорення є збалансованими у представленні даних клінічних досліджень, включаючи будь-які дані, які свідчать про обережність у використанні продукту, і, зокрема, включаючи усі попередження, видані FDA.
Моніторинг забезпечення якості
Що стосується використання «не за призначенням», діяльність Міністерства оборони США полягає у підтримці регулярної системи моніторингу забезпечення якості результатів і відомих потенційних побічних ефектів. З цієї причини підкреслюється важливість ведення точних клінічних записів.
Інформація для пацієнтів
Належна клінічна практика передбачає надання відповідної інформації пацієнтам. У кожних Настановах з клінічної практики, де йдеться про використання засобу «не за призначенням», розглядається питання інформування пацієнтів. За умови практичної доцільності, слід розглянути можливість включення додатка з інформаційним листком для пацієнтів, що видаватиметься до або після застосування продукту. Інформаційний листок має в доступній для пацієнтів формі повідомляти наступне: a) що дане застосування не схвалене FDA; b) причини, чому медичний працівник Міністерства оборони США може прийняти рішення використати продукт з цією метою; c) потенційні ризики, пов’язані з таким застосуванням.






























