Визначення
Цільна кров, взяття якої виконується з використанням антикоагулянтів CPD або CPDA-1, вважається продуктом, схваленим FDA, якщо її належний збір, зберігання та аналіз на патогени, що передаються під час трансфузії (Transfusion-Transmitted Diseases, TTD), виконуються сертифікованим донорським центром. Її можна зберігати протягом 21 дня при температурі 1–6 °C у CPD або протягом 35 днів при температурі 1–6 °C у CPDA-1. У цих настановах таку цільну кров визначено як «консервована цільна кров», КЦК (stored whole blood, SWB). КЦК зберігає гемостатичні показники in vitro на прийнятному рівні протягом схваленого терміну зберігання.1 Проте після перших 2 тижнів гемостатична функція цільної крові може змінитися, тому може вимагатися додавання більш свіжих доз цільної крові або її компонентів, особливо тромбоцитів.
Свіжа цільна кров, СЦК (fresh whole blood, FWB) — це цільна кров, зібрана в екстреній ситуації у донора — «живого банку крові» (walking blood bank, WBB). Свіжу цільну кров можна зберігати при кімнатній температурі та використовувати її не пізніше 24 годин після забору (після спливання цього терміну її слід утилізувати). Як альтернатива, свіжу цільну кров можна перенести на зберігання в холодильник не пізніше 8 годин після забору — після цього вона вважається WBB-SWB (консервована цільна кров, взята у живого банку крові). Вважається, що свіжа цільна кров зберігає повну гемостатичну функцію. За можливості, свіжу цільну кров слід брати у донорів, яким попередньо було виконано аналізи, проте перед переливанням аналіз на TTD не виконується; з огляду на цей факт для такого продукту крові схвалення FDA отримати неможливо. Оскільки при використанні свіжої цільної крові ризик передачі захворювання є вищим, її використання обмежено ситуаціями, коли перевірені продукти крові недоступні або неефективні (детальніший розгляд представлено нижче).
Найважливішим міркуванням щодо безпеки при переливанні цільної крові є те, що донорські еритроцити мають бути сумісними з реципієнтом, щоб уникнути гострих гемолітичних трансфузійних реакцій (також відомих як критична несумісність). Цільна кров від донорів з O(I) групою крові містить еритроцити, які сумісні з усіма реципієнтами, але плазма O(I) групи може містити анти-A та анти-B антитіла, які можуть спричинити гемоліз у реципієнта не з O(I) групою крові (явище, також відоме як незначна несумісність). Існує два підходи для пом’якшення цього ризику: Переливати лише цільну кров ідентичної групи (тобто A(II) до A(II), B(III) до B(III), AB(IV) до AB(IV) і O(I) до O(I) ) або Титри анти-A та анти-B антитіл можна виміряти в цільній крові групи O(I) і використовувати лише дози, що містять низький титр антитіл (наприклад <1:256 розведення у фізіологічному розчині, метод негайного центрифугування). Ці дози позначаються як «цільна кров O(I) групи з низьким титром антитіл» (low titer O WB, LTOWB) і використовуються як «універсальна цільна кров». LTOWB широко використовувалася для реанімації поранених і була стандартом лікування під час Другої світової війни та конфліктів у Кореї та В’єтнамі.2 Зауважте, що як LTOWB можна використовувати або консервовану цільну кров (SWB), або кров, взяту у попередньо перевірених донорів O(I) групи як «живих банків крові»; таким чином, вона вважатиметься свіжою цільною кров’ю (наприклад, Ranger O Low titer або протокол ROLO).3 На практиці єдиною консервованою цільною кров’ю, що постачається Програмою крові збройних сил (ASBP) до місць дислокації, є LTOWB — з огляду на відносно вищий ризик несумісності крові донора та реципієнта і, як наслідок, гемолізу під час трансфузії цільної крові, сумісної за групою, порівняно зі значно нижчим ризиком гемолізу при використанні LTOWB.2 Забір LTOWB у попередньо перевірених донорів («живих банків крові») є кращим вибором, ніж переливання крові за групою. Підсумовуючи, більшість цільної крові, що використовуватиметься при переливанні під час майбутніх операцій, буде належати до LTOWB, більшість з якої становитиме консервована цільна кров. Використання LTOWB підтверджено стандартом AABB (Американської асоціації банків крові) 5.15.1 (Стандарти AABB, 31-а редакція, чинна з 1 квітня 2018 р.).4
Слід зауважити, що у донорів з O(I) групою титри антитіл анти-A та анти-B можуть бути різними. В ідеалі, перевірку титрів у донорів слід виконувати кожні 90 днів у поєднанні з аналізами на TTD. Проте з огляду на надзвичайно обмежені можливості виконання аналізів на титри антитіл у фронтових умовах слід докладати всіх зусиль для перевірки донорів щонайменше раз на рік, або, бажано, перед кожною місією. Програма крові збройних сил (ASBP) проводить забір крові у донорів чоловічої статі і донорів жіночої статі, які ніколи не були вагітними, або у донорів жіночої статі з негативним результатом аналізу на антитіла до HLA (це зменшує ризик гострого ураження легень, пов’язаного з переливанням крові, TRALI). Забір цільної крові виконується у резус-позитивних донорів; у фронтових умовах запас резус-негативних продуктів крові є обмеженим. Слід докласти всіх зусиль, щоб забезпечити резус-негативну цільну кров або еритроцити для жінок з дітородним потенціалом (віком <50 років), які є резус-негативними або група крові у яких не визначена. Водночас, якщо таким пацієнткам буде виконано переливання резус-позитивних продуктів крові, це слід ретельно задокументувати в медичній карті пацієнтки через ризик алоімунізації до резус-фактора та потенційну можливість розвитку гемолітичної хвороби плода/новонародженого (ГХПН) під час майбутніх вагітностей.
Під час реанімаційних заходів у зв’язку з масивною крововтратою можна використовувати всі продукти цільної крові (консервовану цільну кров (SWB), свіжу цільну кров (FWB) та LTOWB). На догоспітальному етапі лікування пацієнтів з геморагічним шоком оптимальним засобом для ресусцитації є цільна кров, особливо LTOWB.5,6 Ці настанови розглядають консервовану цільну кров (SWB) і свіжу цільну кров (FWB) як два окремі продукти та обговорюють обмеження кожного з них.
Вихідна інформація
Перше задокументоване переливання крові від тварини до тварини (собаки) було виконане в Оксфорді в 1665 році Річардом Лоуером (Richard Lower), тоді як перше переливання крові від тварини до людини здійснив Жан Дені (Jean Denis) в 1667 році. Перше переливання крові від людини до людини здійснив Джеймс Бланделл (James Blundell) у 1818 році. У 1900 році Карл Ландштайнер (Karl Landsteiner) запропонував класифікацію груп крові ABO. На її основі Рубен Оттенберг (Reuben Ottenberg) виконав першу перевірку перехресної сумісності перед переливанням крові у 1907 році. Систему типування за резус-фактором винайшли Ландштайнер і Вінер у 1940 році.7 У військових умовах цільну кров для реанімації постраждалих у військових конфліктах почали широко використовувати з 1917 року, під час Першої світової війни.8 Цільна кров є відправною точкою для донорства крові і надалі широко застосовується в тих регіонах світу, де виробництво компонентів недоступне.
Безпечність і постійний запас крові є питаннями міжнародної ваги. У ситуаціях, коли попит перевищує пропозицію, безперервність надання послуг забезпечується виробленням компонентів крові. Використання компонентів також дозволяє забезпечити оптимальні умови зберігання для кожного зі складників крові, мінімізувати гемолітичні реакції та сприяти точності терапевтичного втручання. До прикладів належить використання еритроцитів для лікування анемії, свіжозамороженої плазми (СЗП) для заміни втрачених або витрачених факторів згортання крові, тромбоцитів для лікування аномалій тромбоцитів і тромбоцитопенії та кріопреципітату для лікування гіперфібриногенемії. Цільна кров містить усі ці елементи в меншому об’ємі антикоагулянту і, таким чином, пропонує більш концентрований продукт для лікування пацієнтів із кровотечею, яким потрібно замінити всі елементи крові. Широке використання компонентної терапії обумовлене наявністю продуктів крові. З міркувань, описаних вище, банки крові віддають перевагу зберіганню компонентів, а не цільної крові.
Нещодавно було переглянуто клінічні дані, що порівнюють використання цільної крові з компонентами.6 Наявні зараз клінічні дані вказують на те, що використання цільної крові для лікування кровотечі призводить до результатів, які є принаймні такими ж сприятливими, як і ті, що можна очікувати при компонентній терапії з використанням еритроцитів, плазми та тромбоцитів.
Військовослужбовці з тяжкими пораненнями, які потребують переливання крові, мають значний рівень смертності (16%) і водночас найбільший потенціал отримати користь від своєчасних та відповідних стратегій переливання крові. Велике ретроспективне когортне дослідження поранених, які потребували переливання крові під час операцій в Іраку (Operations Iraqi Freedom, OIF, та Enduring Freedom, OEF), свідчить те, що переливання еритроцитів, свіжозамороженої плазми та тромбоцитів у співвідношенні 1:1:1 істотним чином підвищувало виживаність поранених.9 Нещодавнє рандомізоване дослідження за участю цивільних пацієнтів із травмами продемонструвало, що переливання продуктів крові у співвідношенні 1:1:1 дозволило покращити ранній гемостаз, хоча статистично значущого підвищення виживаності не спостерігалося.10 Також було опубліковано два ретроспективних аналізи, що порівнювали застосування цільної крові з компонентною терапією (яка включала тромбоцити) при бойових пораненнях. В одному дослідженні було продемонстровано потенційний позитивний вплив на показник виживаності при використанні свіжої цільної крові під час реанімації тяжких поранених, тоді як в іншому було показано, що свіжа цільна кров еквівалентна компонентній терапії.11,12 Ці дослідження підкреслюють важливість застосування всіх елементів цільної крові (еритроцитів, плазми і тромбоцитів) у пацієнтів із сильною кровотечею та вказують на прийнятність використання цільної крові або компонентів у співвідношенні 1:1:1 для реанімації пацієнтів із кровотечею; при виборі продукту можна керуватися практичними міркуваннями.
Переваги цільної крові над компонентами
Консервована цільна кров і свіжа цільна кров забезпечують плазму, еритроцити і тромбоцити у фізіологічному співвідношенні та повертають пацієнту з кровотечею те, що було втрачено. Слід зазначити, що співвідношення компонентів крові 1:1:1 (тромбоцити : плазма : еритроцити), рекомендоване для реанімаційних заходів з контролем пошкоджень, не забезпечує точного відновлення цільної крові. Співвідношення 1:1:1 забезпечує розбавлену суміш крові з гематокритом 29%,13 кількістю тромбоцитів приблизно 90 000/мкл і факторами згортання крові, розбавленими приблизно до 62% концентрації цільної крові через наявність антикоагулянтів і адитивного розчину еритроцитів. Крім того, цільна кров містить всі необхідні елементи крові всього в одному продукті, для зберігання якого вимагається лише охолодження. Компонентна терапія, натомість, вимагає кількох продуктів і способів зберігання (охолодження, заморожування та, як правило, зберігання при кімнатній температурі з перемішуванням для тромбоцитів, хоча тромбоцити також можна охолоджувати), що значно збільшує робоче навантаження та ускладнює роботу лікарських бригад.
Консервована цільна кров, отримана в ліцензованих центрах крові, забезпечує такий самий рівень безпеки TTD, як і компоненти крові, отримані в ліцензованих центрах. Слід зазначити, що через надзвичайно короткий термін придатності тромбоцитів, що зберігаються при кімнатній температурі (5 днів), збір усіх продуктів тромбоцитів для переливання у фронтових умовах виконується в зоні бойових дій без аналізу на TTD перед трансфузією. Таким чином, при використанні консервованої цільної крові, отриманої у ліцензованих центрах і повністю проаналізованої, ризик виникнення TTD є нижчим, ніж при застосуванні компонентної терапії з використанням тромбоцитів, зібраних у зоні бойових дій, або свіжої цільної крові.
Для поранених військовослужбовців із геморагічним шоком стратегія переливання, що включала свіжу цільну кров з еритроцитами та плазмою, була пов’язана з підвищенням виживаності порівняно з використанням лише консервованих компонентів (свіжозамороженої плазми, еритроцитів та тромбоцитів).11 Порівняно з консервованою цільною кров’ю або компонентною терапією, свіжа цільна кров є більш доступною в умовах з обмеженим забезпеченням і вимагає лише наявності донорів і простого обладнання для збору крові. Водночас слід зазначити, що безпечний збір і переливання свіжої цільної крові вимагає відповідного навчання перед відправленням у місце дислокації14,15 і ретельного обстеження донора. На відміну від законсервованих продуктів, у свіжій цільній крові зберігається активність лабільних факторів згортання крові або тромбоцитів, її гематокрит близький до фізіологічного, а також в ній відсутні пошкодження еритроцитів, що виникають при зберіганні. Терміном «пошкодження, що виникають при зберіганні», описується деградація еритроцитів, що включає втрату пластичності мембрани,11,12 вичерпання дифосфогліцерату, аденозинтрифосфату, оксиду азоту та інших факторів, що потенційно призводить до погіршеного постачання тканин киснем і сприяє різноманітним патофізіологічним процесам.16 Слід зазначити, що нещодавні рандомізовані дослідження, які оцінювали вплив терміну зберігання еритроцитів, не виявили клінічно підтвердженого шкідливого ефекту пошкоджень еритроцитів, що виникають при зберіганні, у досліджуваних популяціях. Вплив терміну зберігання еритроцитів, незалежно від того, чи це компонентна терапія, чи консервована цільна кров, не був ретельно оцінений у певних уразливих популяціях, таких як пацієнти з травмами.17
Загалом і консервована цільна кров, і свіжа цільна кров пропонують принаймні порівнянну ефективність і безпечність порівняно з компонентами крові, а також переконливі логістичні переваги, які є особливо важливими для догоспітальної реанімації та, загалом, для більшості ситуацій у фронтових умовах.
Міркування щодо вибору консервованої цільної крові або свіжої цільної крові
З використанням свіжої цільної крові пов’язані певні ризики, в тому числі підвищений ризик інфекцій, що передаються під час трансфузії (наприклад ВІЛ, гепатит B/C, сифіліс), і підвищений ризик технічних помилок, що призводять до критичної несумісності при переливанні крові ідентичної групи з огляду на потенційно хаотичні умови, в яких надається запит на свіжу цільну кров. Крім того, польові умови за своєю суттю є антисанітарними та підвищують ризик бактеріального зараження крові. Після виконання приблизно 10 000 трансфузій свіжої цільної крові військовослужбовцям США під час нещодавніх операцій в Іраку виникли такі побічні ефекти: один випадок зараження гепатитом С (HCV), один випадок зараження вірусом Т-лімфоцитів людини (HTLV), а також один летальний випадок пов’язаної з трансфузією реакції «трансплантат проти господаря», яка була потенційно викликана переливанням свіжої цільної крові.4 Свіжа цільна кров не схвалена FDA і не призначена для стандартного використання. З міркувань зручності НЕ доцільно використовувати свіжу цільну кров як альтернативу більш суворо контрольованим продуктам крові для пацієнтів, які не мають серйозних травм, що становлять безпосередню загрозу для життя. Свіжу цільну кров слід використовувати лише тоді, коли інші продукти крові не можуть бути доставлені з прийнятною швидкістю для підтримки реанімаційних заходів у пацієнта з активною кровотечею, коли окремі консервовані продукти недоступні (наприклад консервована цільна кров, еритроцити, свіжозаморожена плазма, тромбоцити, кріопреципітат) або коли консервовані компоненти не забезпечують потрібної швидкості реанімаційних заходів у пацієнта з травмою, що становить безпосередню загрозу для життя. Не слід виконувати збір свіжої цільної крові у попередньо перевірених донорів як спосіб підтримувати стандартний запас консервованої цільної крові, взятої у «живих банків крові». Іншими словами, свіжу цільну кров допускається збирати у «живих банків крові» лише в екстрених ситуаціях. Слід зазначити, що за результатами досліджень донорів свіжої цільної крові, істотне зниження їхньої здатності виконувати бойові завдання після здачі крові не спостерігалося. Таким чином, занепокоєння, що збір свіжої цільної крові негативно вплине на виконання бойових завдань, не підтвердилися, тому в ситуаціях, що виправдовують використання свіжої цільної крові, допускається залучати «живі банки крові».18
У пацієнтів, які отримують LTOWB (цільну кров O(I) групи з низьким титром антитіл у вигляді консервованої цільної крові або свіжої цільної крові), слід докласти всіх зусиль, щоб отримати зразок крові перед переливанням для визначення вихідної групи крові. Якщо зразки крові беруться після переливання LTOWB, остаточно встановити групу крові пацієнта може бути неможливо з використанням обладнання, доступного у фронтових умовах. Як наслідок, пацієнти з невідомою групою крові, які отримують LTOWB, надалі отримуватимуть LTOWB або дози еритроцитів O(I) групи у зв’язку з гострою потребою в переливанні протягом періоду тривалістю до одного місяця після поступлення в медичний заклад. Це може виснажити запас LTOWB і еритроцитів O(I) групи.
Рекомендації щодо застосування цільної крові
- Консервована цільна кров, яка на практиці буде належати до LTOWB, є оптимальним продуктом для виконання реанімаційних заходів на догоспітальному етапі.
- У закладі з можливістю надання хірургічної допомоги (II рівня або вище), консервована цільна кров (на практиці — LTOWB) або компонентна терапія (включаючи еритроцити, плазму та тромбоцити) можуть використовуватися для реанімаційних заходів з контролем пошкоджень. Консервована цільна кров спрощує переливання крові та може сприяти швидшій реанімації поранених, а також може підвищити здатність закладу ефективно діяти в ситуації масових втрат.
- Свіжу цільну кров слід використовувати для лікування поранених із клінічно значущим шоком або коагулопатією (наприклад, кровотеча з пов’язаним метаболічним ацидозом, тромбоцитопенією або МНВ > 1,5), а також коли консервована цільна кров чи оптимальна компонентна терапія (наприклад, аферез тромбоцитів і свіжозаморожена плазма) недоступні, або у ситуаціях, коли компонентна терапія консервованими продуктами крові не дозволяє забезпечити належну ресусцитацію пацієнта з травмами, що становлять загрозу для життя.
Настанови щодо залучення «живих банків крові» для забезпечення свіжої цільної крові
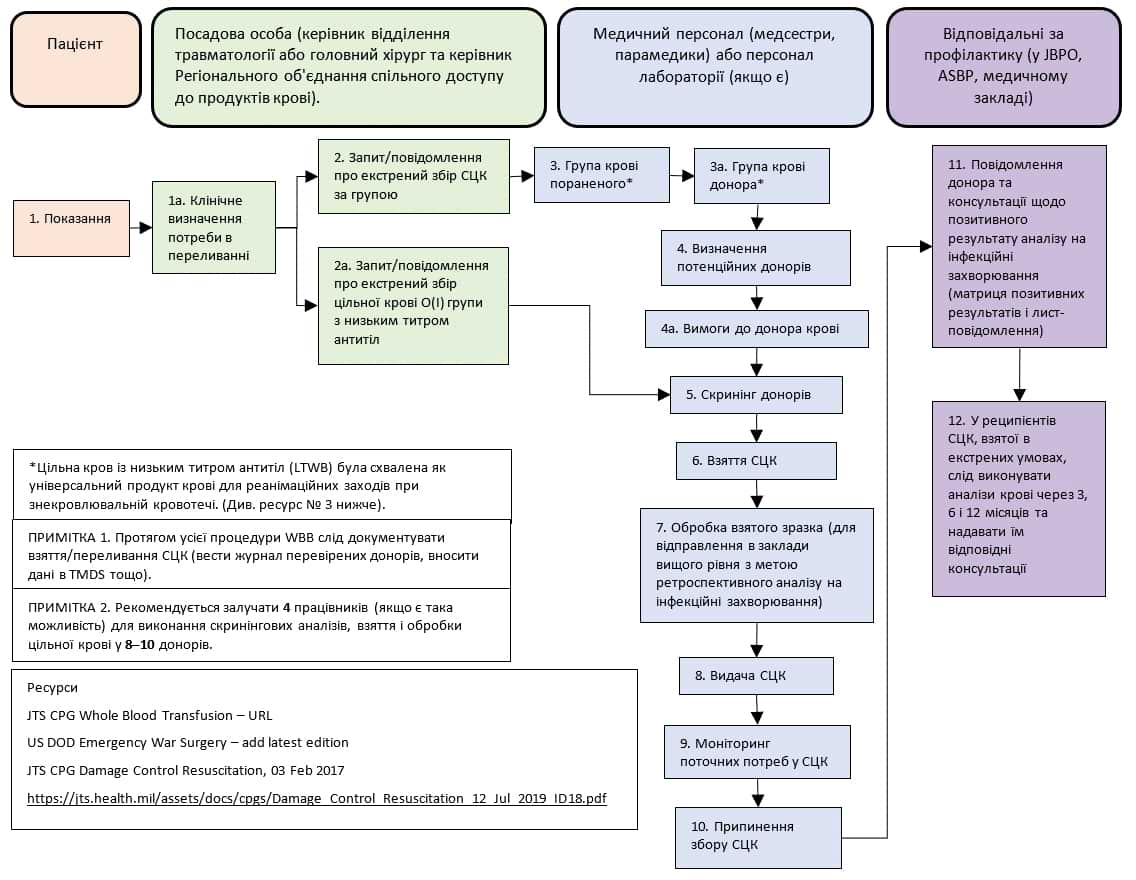
Рішення про використання свіжої цільної крові має приймати лікар, який володіє повними знаннями як про клінічну ситуацію, так і про доступність сумісних продуктів крові. Програму «живих банків крові» слід створювати на основі оцінки ризиків та прогнозованої кількості поранених. Розрахунок ризику має включати оцінку ситуації, виконану медичною розвідкою, яка включає визначення поширеності інфекцій у місці дислокації та необхідності профілактичних заходів для захисту військовослужбовців. На практиці, програму «живих банків крові» слід створювати в усіх медичних закладах поблизу лінії фронту. Для створення цієї програми вимагається координація з керівником Регіонального об’єднання спільного доступу до продуктів крові (Area Joint Blood Program Officer, AJBPO). (Додаток B. Стандартні операційні процедури для попередньої оцінки донорів [СОП]). Збір свіжої цільної крові для трансфузії слід виконувати згідно з Додаток C. Стандартні операційні процедури екстреного збору свіжої цільної крові. Загалом, свіжу цільну кров слід використовувати виключно у поранених, для яких передбачається потреба в трансфузії, якщо лікар визначить, що консервована цільна кров або оптимальна компонентна терапія є недоступними чи обмеженими, або у пацієнтів, для яких переливання консервованої цільної крові або компонентна терапія виявилися неефективними. Рішення про початок процедури збору свіжої цільної крові слід приймати після консультації з відповідною посадовою особою медичного закладу (наприклад, із заступником керівника клінічної служби (DCCS), директором відділення травматології, хірургом-травматологом) і керівником лабораторії/банку крові. У закладах ІІ рівня рішення про початок процедури збору слід приймати після консультації з головним хірургом та (або) керівником закладу.
У програму WBB бажано включати попередньо перевірених донорів, які є військовослужбовцями на активній службі або в резерві, на активній службі в Національній гвардії, або в інших підрозділах, що підпорядковуються Міноборони. Оптимальними донорами свіжої цільної крові є особи з низьким титром антитіл з O(I) групою крові, які пройшли повну попередню перевірку. Далі розгляньте можливість залучення повністю перевірених донорів з іншими групами крові для переливання за групами (наприклад, А(ІІ) — А(ІІ)). Залучення донорів, яким попередньо було виконано аналізи на TTD, слід розглядати лише якщо інші донори не доступні. Зверніть увагу, що в хаотичних обставинах, таких як надання тактичної допомоги під обстрілом чи ситуації з великою кількістю поранених (MASCAL), або якщо обладнання для визначення групи крові недоступне в достатній кількості, використання свіжої цільної крові O(I) групи з невідомим титром антитіл анти-A та анти-B може бути безпечнішим, ніж спроби визначити сумісність груп крові між донорами та реципієнтами, оскільки ризик гемолізу через значну невідповідність є більшим, ніж ризик переливання одиниць крові O(I) групи з дуже високим титром антитіл (одиниці з дуже високим титром зустрічаються відносно рідко) реципієнту з групою крові, відмінною від O(I). Ця стратегія успішно використовувалася хірургічними бригадами на передовій в Афганістані.19
Попередню перевірку донорів слід виконувати згідно з міжнародними та національними стандартами. Представники сил Коаліції зазвичай не залучаються як донори через національні відмінності в скринінгу на захворювання, що передаються через кров, і відмінності в поширеності захворювань. Забір крові у військовослужбовців коаліційних сил, які пройшли попередню перевірку, допускається за умови, якщо відповідну програму скринінгу було перевірено Службою JBPO (Joint Blood Program Office), а також якщо Головний хірург Оперативного командування і директор ASBP визнали її прийнятною. Планові заходи коаліційних сил мають враховувати сумісність аналізів, що виконуються донорам. Громадян іноземних країн, що не входять до складу коаліції, слід залучати лише як крайній захід.
Рішення про використання свіжої цільної крові, яка не пройшла повну перевірку на інфекційні патогени, належить до медичних рішень, що слід приймати після ретельного розгляду ризиків і переваг. Процес прийняття рішень слід належним чином задокументувати в медичній карті пораненого. Іноді на етикетках вказують помилкову групу крові (згідно з останніми даними, неточність становить близько 4%)20-22, тому при визначенні групи крові донорів або реципієнтів не слід покладатися виключно на написи на етикетках. Для підтвердження групи крові і резусу етикетки слід використовувати лише як крайній захід.
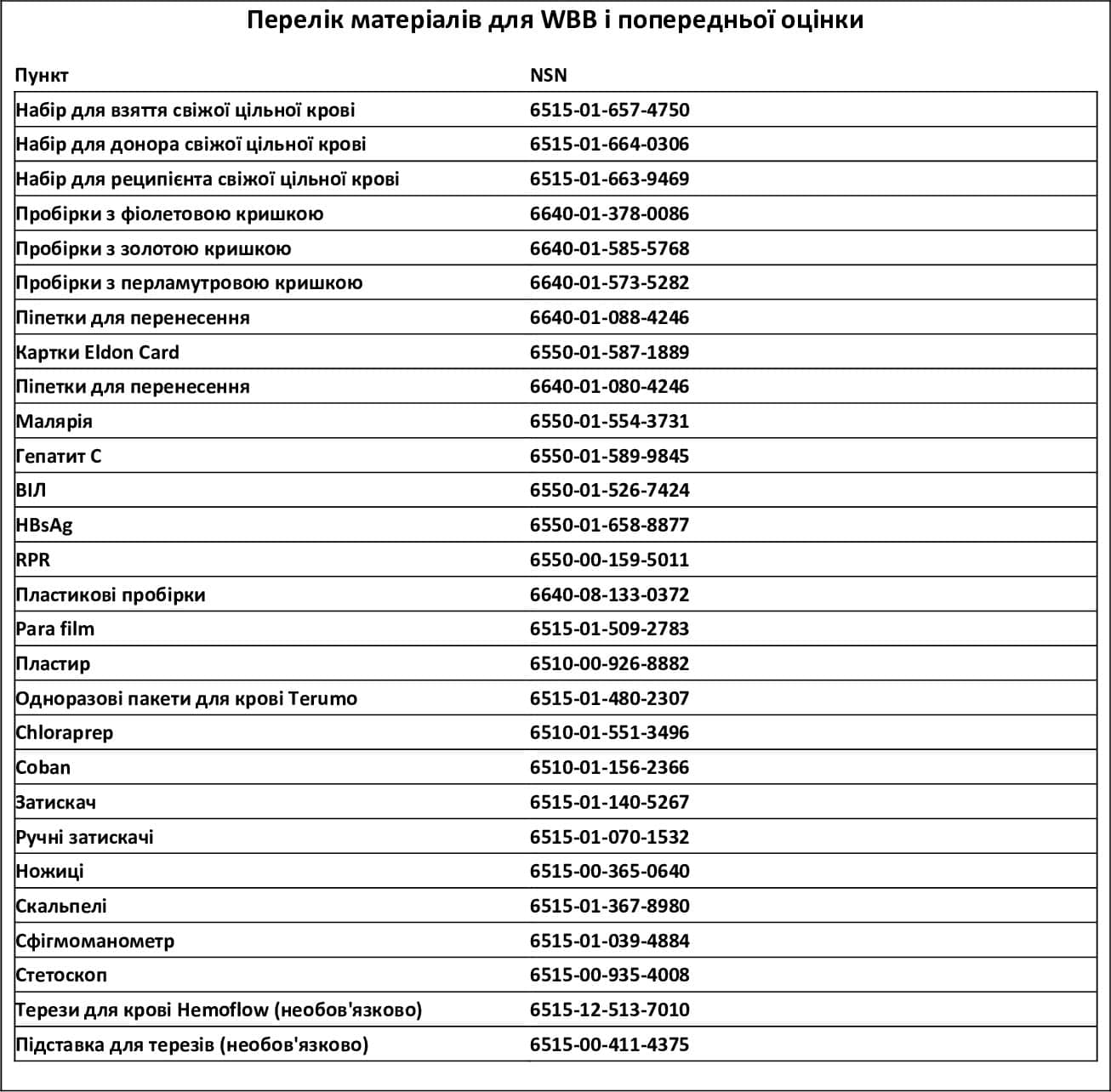
Використання нестандартного матеріалу та обладнання для взяття донорської крові може призвести до коагуляції під час взяття крові, що потенційно може спричинити небажану трансфузійну реакцію; тому слід використовувати лише схвалене обладнання (Додаток C: перелік матеріалів для WBB [із NSN]).
Перш ніж видавати свіжу цільну кров для переливання, слід підтвердити групу крові і резус-фактор, а також виконати експрес-тест на інфекційні захворювання (наприклад ВІЛ, гепатит C і гепатит B), як описано в Додатку C: Стандартні операційні процедури екстреного збору свіжої цільної крові в такому обсязі, в якому це можливо.
Взяття донорської крові та результати аналізів на інфекційні захворювання слід реєструвати в Базі медичних даних з театру бойових дій (TMDS).
Слід відстежувати частоту взяття свіжої цільної крові. Загалом, взяття свіжої крові у донорів слід виконувати не частіше ніж кожні 8 тижнів (56 днів). Важливо дотримуватися цього інтервалу, щоб у донорів відновилася еритроцитарна маса і запас заліза. Скорочувати інтервал допускається лише в найскладніших обставинах. У донорів, які часто здають кров, дефіцит заліза може розвинутися навіть при відсутності анемії. При відсутності лікування дефіцит заліза може викликати втому, труднощі із концентрацією, парорексію, синдром неспокійних ніг і, зрештою, анемію. Дефіцит заліза можна діагностувати шляхом вимірювання рівня феритину в сироватці крові (дефіцит визначається як рівень феритину <30 мкг/л у чоловіків і <20 мкг/л у жінок). У фронтових умовах може не бути можливостей для визначення рівня феритину, але до донорів із особливим ризиком дефіциту заліза належать: молоді донори (до 20 років), жінки в пременопаузі, часті донори (чоловіки >3 разів/рік, жінки >2 разів/рік) і донори, близькі до мінімального допустимого рівня гемоглобіну для донорства (чоловіки 13,0 г/дл, жінки 12,5 г/дл). Слід розглянути можливість виконання аналізів на феритин у донорів із високим ризиком перед їх відправленням у зону бойових дій, особливо у донорів з низьким титром антитіл з O(I) групою крові, яких можуть частіше залучати до донорства. Слід розглянути застосування препаратів заліза у донорів з високим ризиком або донорів із симптомами дефіциту заліза (доступні у вигляді сульфату заліза 325 мг (65 мг елементарного заліза), глюконату заліза 325 мг (38 мг елементарного заліза) або полівітамінів із вмістом заліза (18–19 мг елементарного заліза); одна таблетка на добу протягом 60–120 днів може бути достатньою для поповнення запасів заліза.23, 24 Пацієнтам із документально підтвердженим дефіцитом заліза (низький рівень феритину, як зазначено вище) слід запропонувати прийом препаратів заліза та спостерігати за відповіддю на лікування.
Планування WBB
Оскільки потреби у FWB передбачити неможливо, працівники медичних закладів повинні розробити надійний оперативний план на випадок непередбачених ситуацій, що має залучати лабораторію/банк крові та хірургічні й анестезіологічні бригади у координації з керівником Регіонального об’єднання спільного доступу до продуктів крові. Слід регулярно оновлювати план і виконувати відповідні симуляції. Потрібно виконувати перевірку обладнання та витратних матеріалів, звертаючи належну увагу на умови зберігання та терміни придатності.
Ключовими елементами для планування та готовності до застосування свіжої цільної крові є ознайомлення та виконання симуляцій із двома СОП: Попередня оцінка донорів (Додаток B) і Екстрений збір свіжої цільної крові (Додаток C).
- Необхідно розробити план дій на випадок непередбачених ситуацій для збору, зберігання та переливання свіжої цільної крові у ситуаціях з великою кількістю поранених або при підозрі, що поточний запас крові буде вичерпано перед поповненням (наприклад, коли запас еритроцитів 0(І) групи витрачається для лікування декількох поранених, які вимагають переливання цього типу крові).
- Місце забору крові слід організувати таким чином, щоб забезпечити безперебійне виконання скринінгових аналізів і процедури взяття крові, а також мінімізувати можливість технічних помилок. Це особливо важливо у екстрених ситуаціях із більш ніж одним пораненим.
- Слід докласти всіх зусиль, щоб дотримуватись таких самих стандартів скринінгових аналізів, взяття крові, маркування та видачі, які вимагаються для продуктів крові, схвалених FDA США.
- В першу чергу слід максимально залучати перевірених донорів із програми WBB, після чого допускається брати кров у військовослужбовців, які: 1) проходили перевірку або здавали кров у минулому, проте яким не виконували перевірку та аналізи на інфекційні захворювання протягом останніх 90 днів; 2) раніше не проходили перевірку або не здавали кров. Під час здачі крові всі донори повинні пройти повторну перевірку.
- За можливості залучайте донорів LTOWB (з O(I) групою крові з низьким титром антитіл). В іншому випадку, після визначення групи крові і резус-фактора пораненого, активуйте програму WBB для пошуку донора, який пройшов попередню перевірку і має ідентичну групу крові і резус-фактор, використовуючи відповідну систему обліку. На момент здачі крові у всіх донорів має бути підтверджена група крові і резус-фактор (за допомогою експрес-тесту EldonCard або лабораторного аналізу). Титри антитіл у донорів LTOWB слід отримати перед відправленням у місце дислокації, що зазвичай відбувається не пізніше 12 місяців перед здачею крові. Група крові і резус-фактор мають бути ідентичними із записами на етикетці пакета та в медичній документації. Перед переливанням свіжої цільної крові слід обов’язково виконати експрес-тест крові донора на інфекційні захворювання (ВІЛ, гепатит B, гепатит C) в максимально можливому обсязі.
- Ретроспективні зразки необхідно надіслати до ліцензованої лабораторії для виконання аналізів, схвалених FDA, незалежно від того, чи виконується експрес-тест на інфекційні захворювання до чи після переливання крові, оскільки ці тести не ліцензовані для проведення аналізів у донорів.
- Якщо буде отримано підтвердження наявності інфекційного захворювання, про це повідомлять лікарю або спеціалістам із профілактики, щоб вони надали донору відповідні консультації. Донори і командири підрозділів повинні розуміти важливість відстеження донорів.
- Якщо пацієнту буде введено одиницю крові із підтвердженим інфекційним патогеном, керівник Регіонального об’єднання спільного доступу до продуктів крові повинен негайно повідомити Програму крові збройних сил, щоб поінформувати пацієнта і розпочати обстеження і донора, і пацієнта.
- Відповідно до процедури HA 10-002, процедури щодо використання засобів, не затверджених FDA, реципієнти свіжої цільної крові повинні отримати консультацію щодо подальшого спостереження та тестування на інфекційні захворювання якнайшвидше, а також через 3, 6 та 12 місяців після переливання.
- Процедура. Див. Додаток B: ASBP 572-EWB (Екстрений збір свіжої цільної крові).
- В одного донора слід брати лише одну дозу (одиницю) свіжої цільної крові. При обмеженій кількості донорів та нагальній потребі у крові допускається взяття у донора щонайбільше двох доз крові. Після взяття двох доз крові у донора може спостерігатися погіршення функціональних показників, і може виникнути потреба виконання рідинної реанімації донора. Взяття більше однієї дози крові в одного донора допускається лише в надзвичайно скрутних обставинах, і такі випадки слід ретельно документувати.
Міркування щодо цільної крові для педіатричної популяції
Під час нещодавніх конфліктів повідомлялося про випадки переливання цільної крові пацієнтам дитячого віку.25 Ретельні дослідження щодо застосування цільної крові під час реанімаційних заходів у пацієнтів дитячого віку не проводилися, проте було доведено, що цільна кров зменшує крововтрату і вимоги до трансфузії під час операцій на серці у пацієнтів дитячого віку.11
Клінічні критерії застосування цільної крові у пацієнтів дитячого віку із кровотечею однозначно не визначені. Фізіологічні показники слід інтерпретувати відповідно до віку (наприклад гіпотензія = систолічний артеріальний тиск <70+2х вік у роках).
Пацієнтам з масою тіла <40 кг цільну кров слід вводити у «дозах» по 10–15 мл/кг. Цільну кров легше титрувати за об’ємом, ніж компоненту терапію. Відомих протипоказань до застосування цільної крові у пацієнтів дитячого віку немає.
Масивна трансфузія у дітей визначається як 40 мл/кг (загальний об’єм крові становить приблизно 70–80 мл/кг).25
Моніторинг покращення показників (ПП)
Цільова популяція
- Усі пацієнти, яким виконується переливання продуктів крові не пізніше 3 годин після поранення
- Усі пацієнти, які відповідають критеріям для переливання крові (тяжка травма (ISS >16 та >2 уражених ділянок тіла зі ступенем тяжкості за AIS > ТА САТ < 100 АБО ЧСС > 100 АБО гематокритом < 32 % АБО pH <7,25 не пізніше 3 годин після поранення)
Мета (Очікувані результати)
- Для догоспітальної реанімації поранених із травмами, що становлять загрозу для життя, та гемодинамічною нестабільністю (ЧСС > 100 або САТ < 100) використовується LTOWB.
- Для цільової популяції першою реанімаційною рідиною, що вводиться після поранення, має бути продукт крові, в ідеалі — LTOWB, що зберігається в холодильнику.
Кількісні показники результативності/Дотримання рекомендацій
- Кількість і відсоток пацієнтів із цільової популяції, яким виконують переливання цільної крові перед прибуттям у заклад I рівня.
- Кількість і відсоток пацієнтів із цільової популяції, які отримали продукт крові як першу реанімаційну рідину.
- Кількість і відсоток пацієнтів із цільової популяції, які отримали LTOWB, що зберігається в холодильнику, як першу реанімаційну рідину.
Джерело даних
- Карта пацієнта
- Реєстр травм Міністерства оборони
- Бази даних щодо переливання крові
Системна звітність і частота звітування
Згідно з цими Настановами, вказане вище становить мінімальні критерії моніторингу ПП. Системна звітність виконуватиметься щороку; додатковий моніторинг ПП та заходи із системної звітності можна виконувати залежно від потреб.
Системний перегляд та аналіз даних виконуватиме керівник JTS та Відділ ПП JTS.
-
- Pidcoke HF, McFaul SJ, Ramasubramanian AK, et al. Primary hemostatic capacity of whole blood: a comprehensive analysis of pathogen reduction and refrigeration effects over time. Transfusion. 2013 Jan;53 Suppl 1:137S-149S.
- Strandenes G, Berséus O, Cap AP, et al. Low titer group O whole blood in emergency situations. Shock. 2014 May;41 Suppl 1:70-5.
- Fisher AD, Miles EA, Cap AP, Strandenes G, Kane SF. Tactical Damage Control Resuscitation. Mil Med. 2015 Aug;180(8):869-75. doi: 10.7205/MILMED-D-14-00721.
- Yazer MH, Cap AP, Spinella PC. Raising the Standards on Whole Blood. J Trauma Acute Care Surg. 2017 Dec 28
- Butler FK, Holcomb JB, Schreiber MA, et al. Fluid Resuscitation for Hemorrhagic Shock in Tactical Combat Casualty Care: TCCC Guidelines Change 14-01--2 June 2014. J Spec Oper Med. 2014 Fall;14(3):13-38.
- Spinella PC, Cap AP. Whole blood: back to the future. Curr Opin Hematol. 2016 Nov;23(6):536-542.
- Arya RC, Wander GS, and Gupta, P. Blood component therapy: Which, when and how much. J Anaesthesiol Clin Pharmacol. 2011 Apr-Jun; 27(2): 278–284.
- Stansbury LG, Hess JR. The 100th anniversary of the first blood bank. Transfusion. 2017 Nov;57(11):2562-2563.
- Pidcoke HF, Aden JK, Mora AG, et al. Ten-year analysis of transfusion in Operation Iraqi Freedom and Operation Enduring Freedom: increased plasma and platelet use correlates with improved survival. J Trauma Acute Care Surg. 2012 Dec;73(6 Suppl 5):S445-52.
- Holcomb JB, Tilley BC, Baraniuk S, et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma: the PROPPR randomized clinical trial. PROPPR Study Group. JAMA. 2015 Feb 3;313(5):471-82.
- Spinella PC, Perkins JG, Grathwohl JG, et al. Warm fresh whole blood is independently associated with improved survival for patients with combat-related traumatic injuries. J Trauma. 2009;66:S69-S76.
- Perkins JG, Cap AP, Spinella PC, et al. Comparison of platelet transfusion as fresh whole blood versus apheresis platelets for massively transfused combat trauma patients (CME). Transfusion. 2011 Feb;51(2):242-52.
- Hess JR. Resuscitation of trauma-induced coagulopathy. Hematology Am Soc Hematol Educ Program. 2013;2013:664-7.
- Strandenes G, De Pasquale M, Cap AP, et al. Emergency whole-blood use in the field: a simplified protocol for collection and transfusion. Shock. 2014 May;41 Suppl 1:76-83.
- Doughty H, Thompson P, Cap AP, et al. A proposed field emergency donor panel questionnaire and triage tool. Transfusion. 2016 Apr;56 Suppl 2:S119-27.
- Hess JR. Measures of stored red blood cell quality. Vox Sang. 2014 Jul;107(1):1-9.
- Belpulsi D, Spitalnik SL, Hod EA. The controversy over the age of blood: what do the clinical trials really teach us? Blood Transfus. 2017 Mar;15(2):112-115.
- Strandenes G, Skogrand H, Spinella PC, et al. Donor performance of combat readiness skills of special forces soldiers are maintained immediately after whole blood donation: a study to support the development of a prehospital fresh whole blood transfusion program. Transfusion. 2013 Mar;53(3):526-30.
- Nessen SC, Eastridge BJ, Cronk D, et al. Fresh whole blood use by forward surgical teams in Afghanistan is associated with improved survival compared to component therapy without platelets. Transfusion. 2013 Jan;53 Suppl 1:107S-113S.
- Rentas FJ1, Clark PA. Blood type discrepancies on military identification cards and tags: a readiness concern in the U.S. Army.Mil Med. 1999 Nov;164(11):785-7.
- Frohman EM. Blood typing errors on U.S. army identification cards and tags. Mil Med. 1989 May;154(5):273-4.
- Gaydos JC, Polk AJ, Cowan DN, et al. Blood typing errors on U.S. Army identification (ID) cards and tags. Mil Med. 1990 Apr;155(4):A19.
- Mast AE, Bialkowski W, Bryant BJ, Wright DJ, Birch R, Kiss JE, D’Andrea P, Cable RG, Spencer BR. A randomized, blinded, placebo-controlled trial of education and iron supplementation for mitigation of iron deficiency in regular blood donors. Transfusion 2016;56:1588-1597. PMID: 26813849
- Bialkowski W, Kiss JE, Wright DJ, Cable RG, Birch R, D’Andrea P, Bryant BJ, Spencer BR, Mast AE. Estimates of total body iron indicate 19 mg and 38 mg oral iron are equivalent for the mitigation of iron deficiency in a longitudinal study. American Journal of Hematology 2017; 92:851-857. PMID: 28494509).
- Repine TB, Perkins JG, Kauvar DS, Blackborne L. The use of fresh whole blood in massive transfusion. J Trauma. 2006;60:S59-S69.
Додаток А. Карта процесу залучення «живих банків крові»
Додаток B. СОП для попередньої оцінки донорів
*Виправлено tccc.org.ua/травень 2024




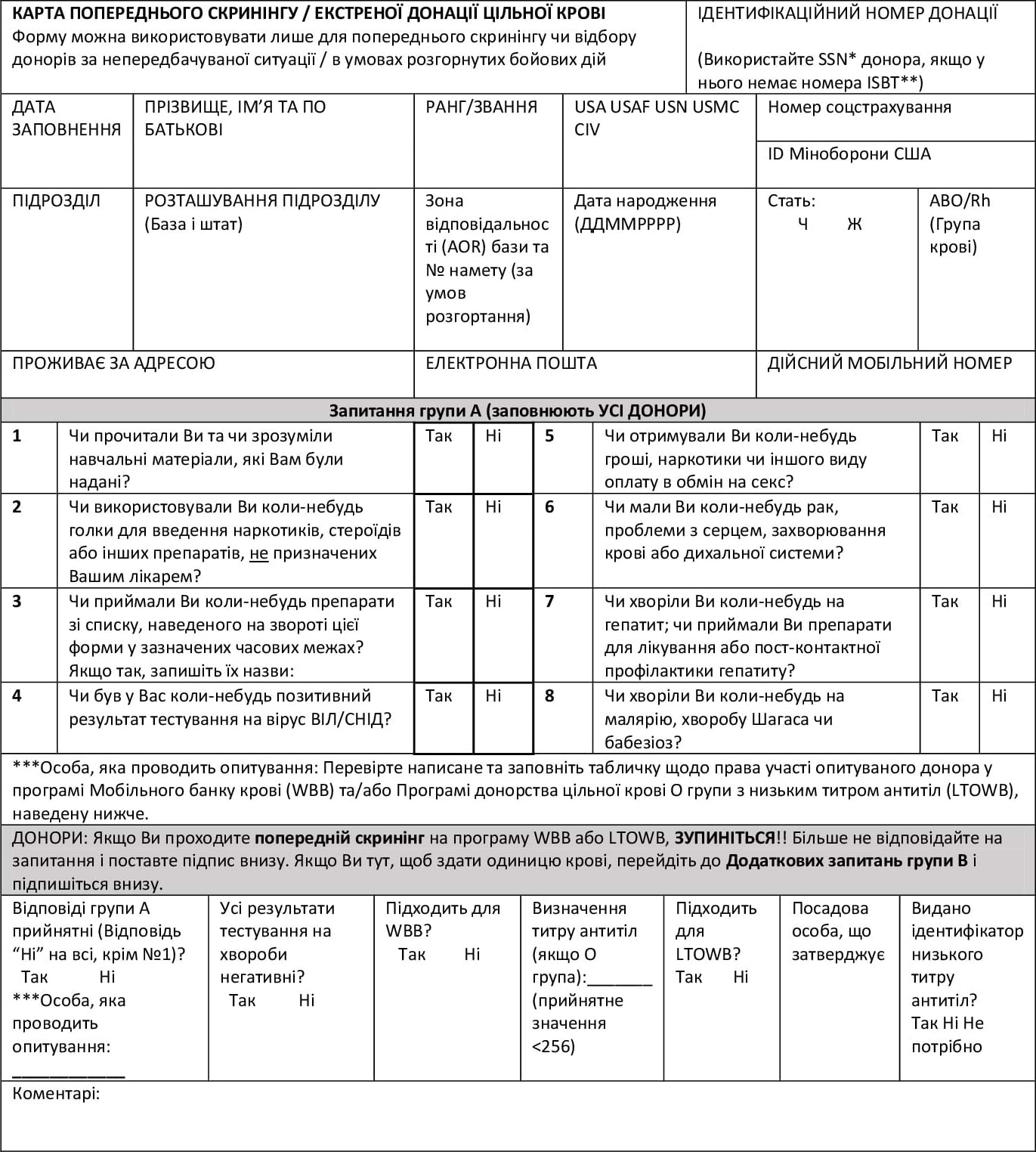
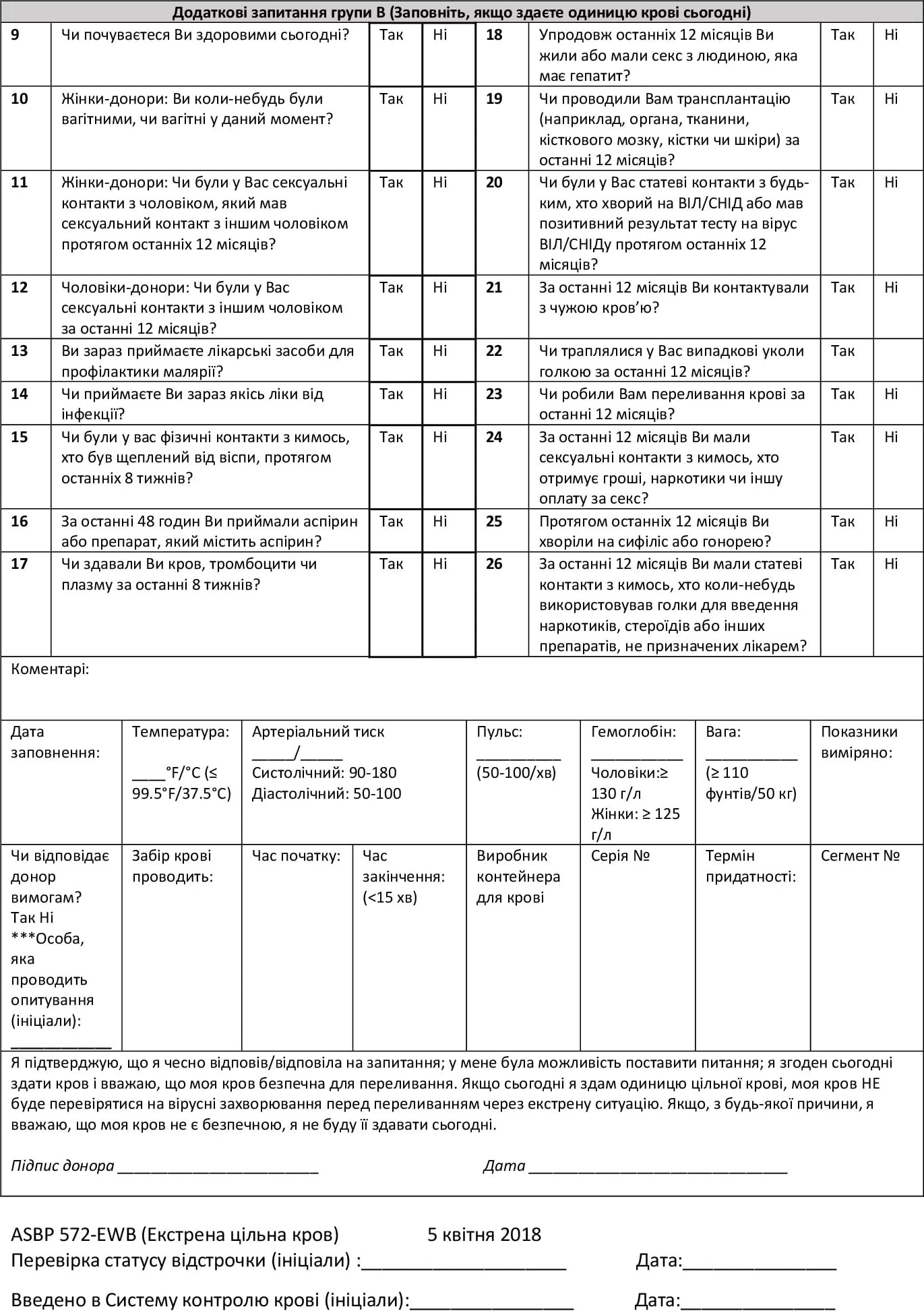
Стандартна операційна процедура попереднього скрінінгу донорської крові: додаток (1)
ASBP 572: Екстрена донація цільної крові (титульна сторона)
ASBP 572: Екстрена донація цільної крові (зворотна сторона)


Стандартна операційна процедура попереднього скрінінгу донорської крові: додаток (2)
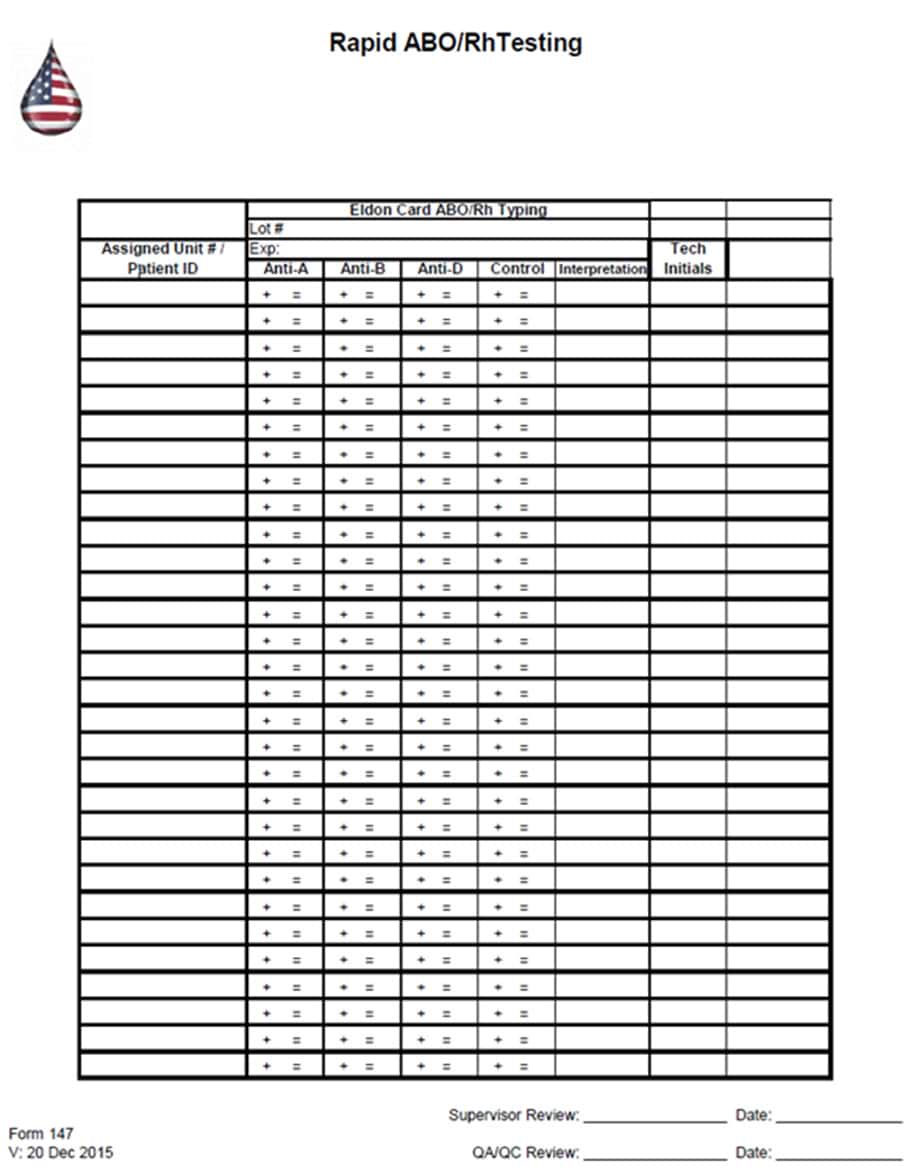
Форма 147-Бланк для запису результатів визначення групи крові за системою ABO та Rh-фактора (за допомогою картки Елдона)
Стандартна операційна процедура попереднього скрінінгу донорської крові: додаток (3)
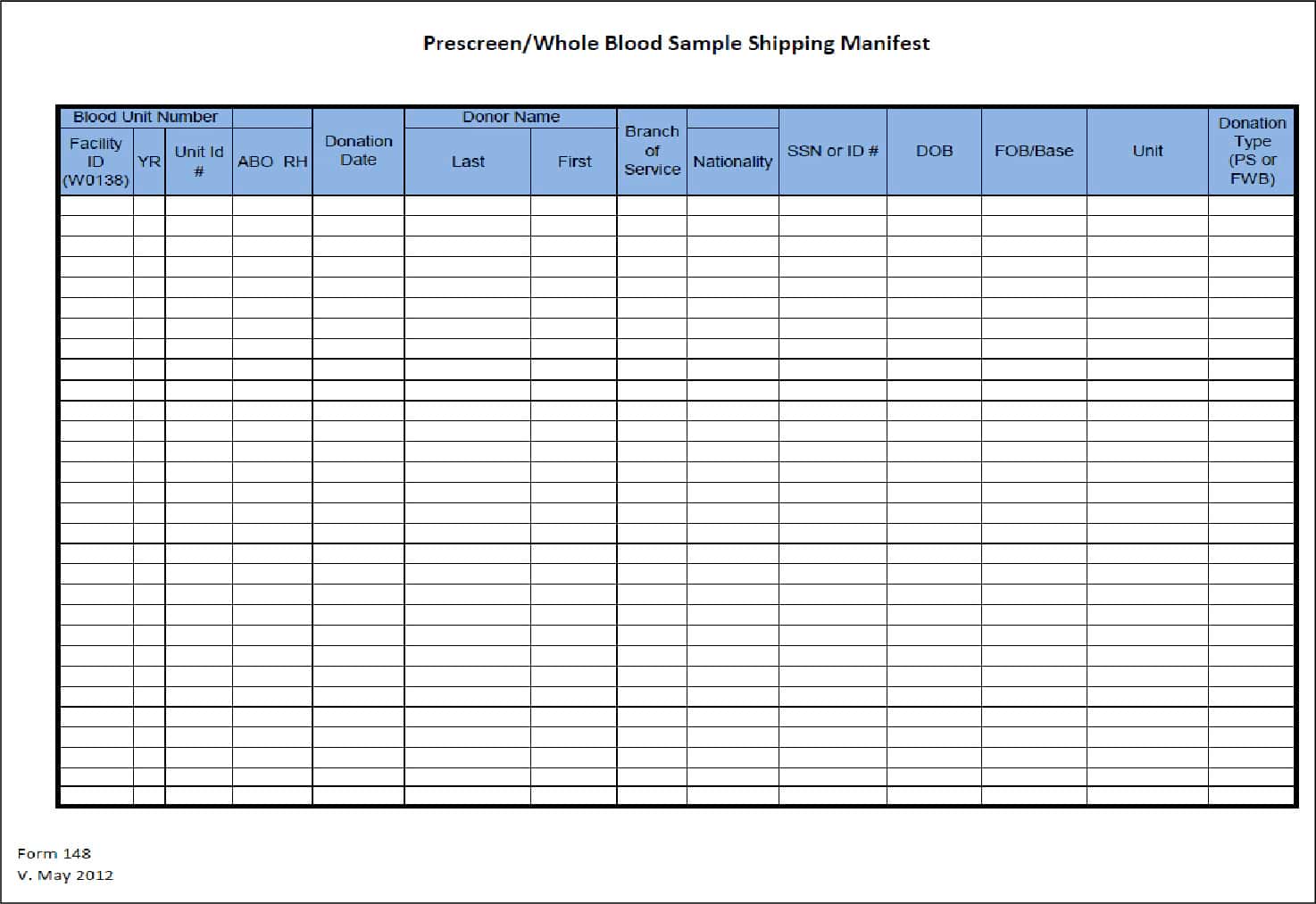
Форма 148 Транспортна декларація для зразка попередньо обстеженої /цільної донорської крові
Додаток C. СОП екстреного збору свіжої цільної крові




Вкладення до СОП екстреного збору свіжої цільної крові (1)
Форма 145. Бланк експрес-тесту
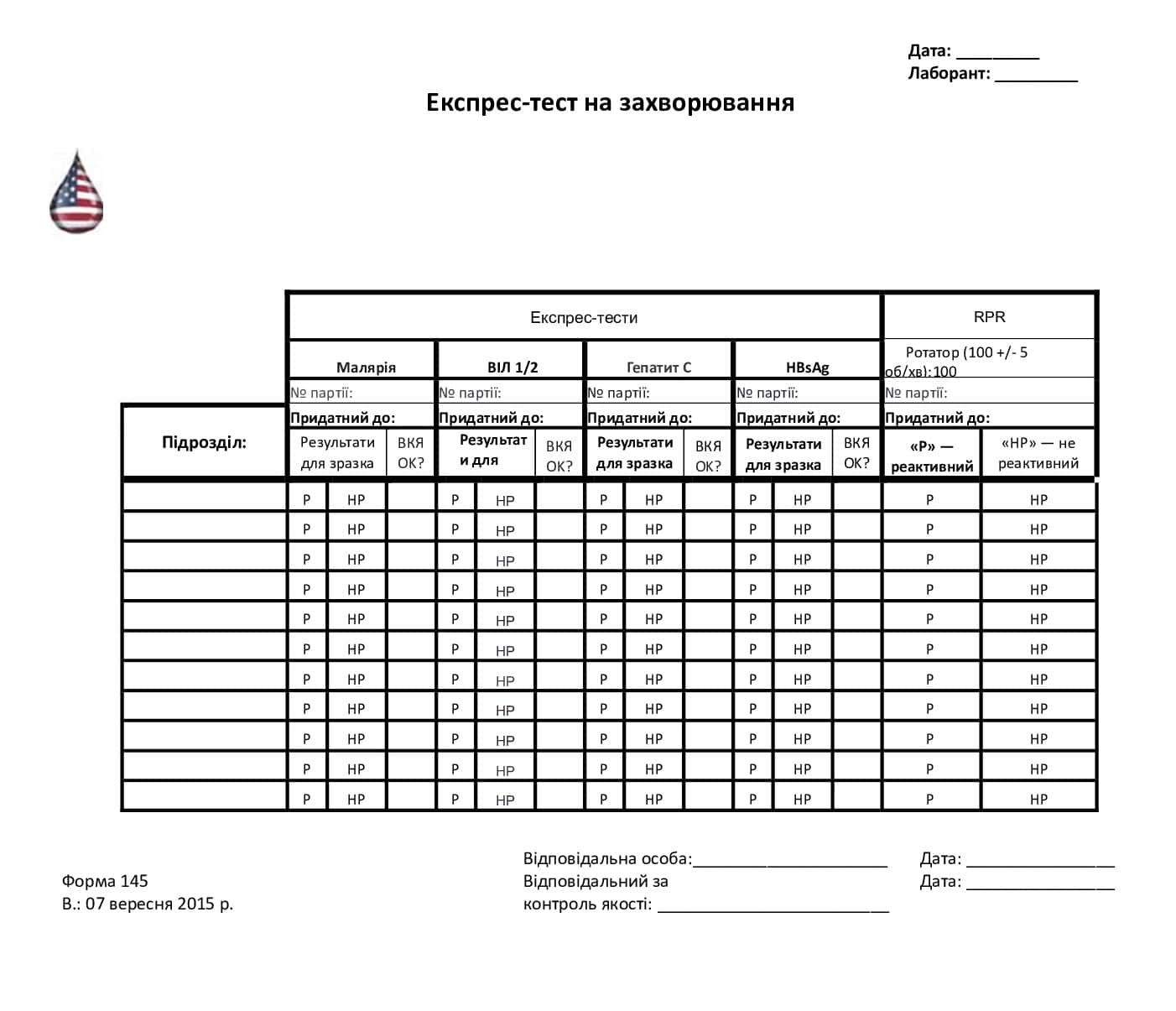
Вкладення до СОП екстреного збору свіжої цільної крові (2)
Форма 150A. Інформаційний лист про екстрене взяття крові (перевіреної)

Вкладення до СОП екстреного збору свіжої цільної крові (3)
Форма 150B. Інформаційний лист про екстрене взяття крові (неперевіреної)

Вкладення до СОП екстреного збору свіжої цільної крові (4)
Форма 151. Контрольний список трансфузії цільної крові

Вкладення до СОП екстреного збору свіжої цільної крові (5)
Стандартна форма 518-123: Видача крові або компонентів крові
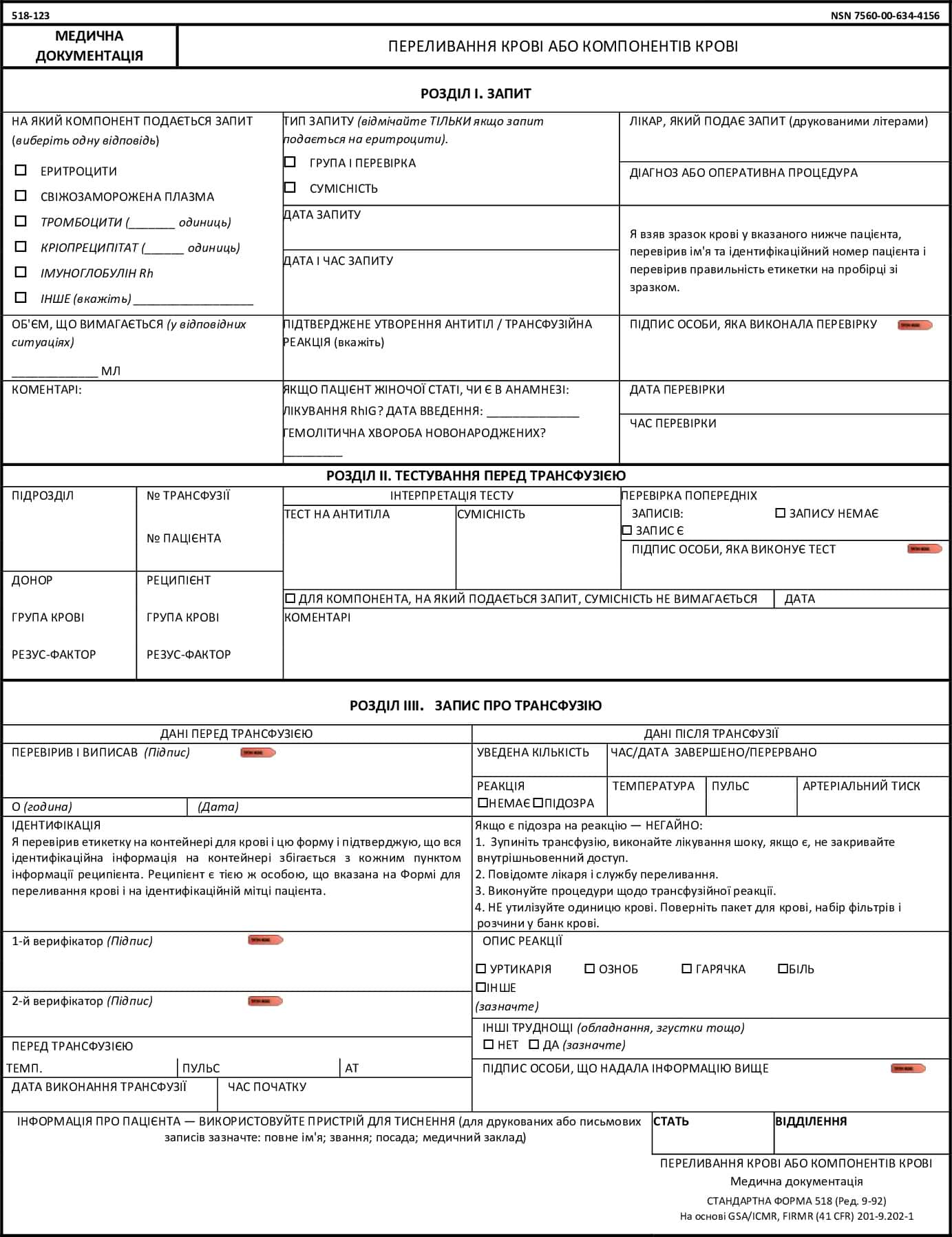
Стандартна форма 518-123: Видача крові або компонентів крові (інструкція)

Вкладення до СОП екстреного збору свіжої цільної крові (6)
Перелік матеріалів для WBB і попередньої оцінки
Додаток D. Додаткова інформація щодо застосування за незатвердженими показаннями згідно з CPG
Мета
Мета цього Додатка — надати роз’яснення політики та практики Міноборони щодо включення в Настанови CPG «незатверджених» показань для продуктів, які були схвалені Управлінням з контролю якості продуктів харчування і лікарських засобів США (FDA)- Це стосується незатверджених показань при застосуванні у пацієнтів, які належать до збройних сил.
Вихідна інформація
Використання продуктів, схвалених FDA, за незатвердженими показаннями, надзвичайно поширене в медицині США і зазвичай не регулюється окремими нормативними актами. Проте, згідно з федеральним законодавством, у деяких обставинах застосування схвалених лікарських засобів за незатвердженими показаннями підлягає нормативним актам FDA, що регулюють використання «досліджуваних лікарських засобів. До цих обставин належить використання в рамках клінічних досліджень, а також, у військовому контексті, використання за незатвердженими показаннями згідно з вимогами командування. Деякі види використання за незатвердженими показаннями також можуть підлягати окремим нормативним актам.
Додаткова інформація щодо застосування за незатвердженими показаннями згідно з CPG
Включення в Настанови CPG застосувань за незатвердженими показаннями не належить до клінічних випробувань і не є вимогою командування. Більше того, таке включення не передбачає, що армійська система охорони здоров’я вимагає, щоб лікарі, які працюють в структурах Міноборони, застосовували відповідні продукти за незатвердженими показаннями або розглядали їх як «стандарт лікування». Натомість, включення в Настанови CPG застосувань за незатвердженими показаннями допомагає відповідальним медичним робітникам виконувати клінічну оцінку завдяки інформації про потенційні ризики та переваги альтернативних видів лікування. Рішення щодо клінічної оцінки належить відповідальному медичному працівнику в рамках відносин «лікар — пацієнт».
Додаткові процедури
Виважений розгляд
Відповідно до вказаної мети, при розгляді застосувань за незатвердженими показаннями в Настановах CPG окремо вказується, що такі показання не схвалені FDA. Крім того, розгляд підкріплений даними клінічних досліджень, в тому числі інформацією про обережне використання продукту та всі попередження, видані FDA.
Моніторинг забезпечення якості
Процедура Міноборони щодо застосувань за незатвердженими показаннями передбачає регулярний моніторинг забезпечення якості з реєстрацією результатів лікування та підтверджених потенційних побічних явищ. З огляду на це ще раз підкреслюється важливість ведення точних медичних записів.
Інформація для пацієнтів
Належна клінічна практика передбачає надання відповідної інформації пацієнтам. У кожних Настановах CPG, що передбачають застосування за незатвердженими показаннями, розглядається питання інформації для пацієнтів. За умови практичної доцільності, слід розглянути можливість включення додатка з інформаційним листком для пацієнтів, що видаватиметься до або після застосування продукту. Інформаційний листок має в доступній для пацієнтів формі містити такі відомості: a) це застосування не схвалене FDA; b) причини, чому медичний працівник зі структури Міноборони може прийняти рішення використати продукт з цією метою; c) потенційні ризики, пов’язані з таким застосуванням.
















































